网址:http://m.1010jiajiao.com/timu3_id_226048[举报]
①甲溶液
| 电解 |
②乙经过粉碎后在沸腾炉中燃烧,得到D和E
其中,A、D在常温常压下为刺激性气味气体,C为无色无味气体.请回答:
(1)A的电子式是
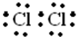
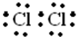
(2)将A通入B的溶液中,反应的离子方程式是
(3)1g C在A中燃烧时放出92.3kJ的热量,该反应的热化学方程式是
(4)工业上可利用E为原料冶炼其中所含的金属,方法是
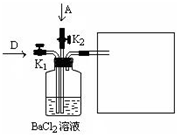
(5)将A和D按物质的量1:1通入如图装置中:
该过程中的化学方程式是
上述实验装置设计不完整,请将所缺部分在装置图的右边方框中画出.
(6)一定条件下,将12g乙放入过量的浓硝酸中,反应过程中转移1.5mol电子,该反应的离子方程式是
在一容积可变的密闭容器中充入10mol CO 和20mol H2,CO的平衡转化率随温度(T)、压强(P)的变化如图1所示,当达到平衡状态A 时,容器的体积为20L.
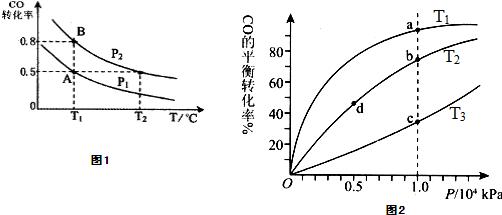
(1)T1℃反应的平衡常数为
(2)图中P1
(3)如反应开始时仍充入10mol CO和20mol H2,则在平衡状态B时容器的体积V(B)=
(4)关于反应CO(g)+2H2(g)?CH3OH(g)在化学平衡状态时的描述正确的是
A.CO的含量保持不变 B.容器中CH3OH浓度与CO浓度相等
C.2v正(CH3OH)=v正(H2) D.容器中混合气体的平均相对分子质量保持不变
(5)CO(g)+2H2(g)?CH3OH(g),按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图2所示.下列说法正确的是
A.温度:T1<T2<T3
B.正反应速率:v(a)>ν(c); v(b)>v(d)
C.平衡常数:K(a)=K(c); K(b)>K(d)
D.平均摩尔质量:M(a)<M(c); M(b)>M(d)
(6)已知CO2(g)+H2(g)?CO(g)+H2O(g)△H=+41.3kJ?mol-1,试写出由CO2和H2制取甲醇的热化学方程式
(7)以甲醇、CO2、空气、熔融盐K2CO3组成燃料电池,写出该电池负极的电极反应式:
甲醇可作为燃料电池的原料。通过下列反应可以制备甲醇:CO ( g ) + 2H2 ( g )  CH3OH ( g ) △H =-90.8 kJ·mol-1 在一容积可变的 密闭容器中充入10 mol CO 和20 molH2,CO 的平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态A 时,容器的体积为20 L。
CH3OH ( g ) △H =-90.8 kJ·mol-1 在一容积可变的 密闭容器中充入10 mol CO 和20 molH2,CO 的平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态A 时,容器的体积为20 L。

(1)该反应的化学平衡常数表达式为????? 。
(2)如反应开始时仍充入10mol CO 和20mol H2,
则在平衡状态B时容器的体积V(B)= ????? L。
(3)关于反应CO(g)+2H2(g) CH3OH(g)在化学平衡状态时的描述正确的是?? (填字母)。
CH3OH(g)在化学平衡状态时的描述正确的是?? (填字母)。
A.CO的含量保持不变
B.容器中CH3OH浓度与CO浓度相等
C.2V正(CH3OH)=V正(H2)
D.容器中混合气体的平均相对分子质量保持不变
(4)CO(g)+2H2(g) CH3OH(g),按照相同的物质的量? 投料,测得CO在? 不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是????? 。
CH3OH(g),按照相同的物质的量? 投料,测得CO在? 不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是????? 。

A.温度:T1 < T2 <T3
B.正反应速率:ν(a)>ν(c); ν(b)>ν(d)
C.平衡常数: K(a) =K(c) ; K(b) >K(d)
D.平均摩尔质量:M(a)<M(c); M(b)>M(d)
(5)已知CO2(g)+H2(g) CO(g)+H2O(g) △H= + 41.3 kJ·mol-1 ,试写出由 CO2和H2制取甲醇的热化学方程式????? 。
CO(g)+H2O(g) △H= + 41.3 kJ·mol-1 ,试写出由 CO2和H2制取甲醇的热化学方程式????? 。
查看习题详情和答案>>
甲醇可作为燃料电池的原料。通过下列反应可以制备甲醇:CO ( g ) + 2H2 ( g )  CH3OH ( g ) △H =-90.8 kJ·mol-1 在一容积可变的 密闭容器中充入10 mol CO 和20 molH2,CO 的平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态A 时,容器的体积为20 L。
CH3OH ( g ) △H =-90.8 kJ·mol-1 在一容积可变的 密闭容器中充入10 mol CO 和20 molH2,CO 的平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态A 时,容器的体积为20 L。

(1)该反应的化学平衡常数表达式为 。
(2)如反应开始时仍充入10mol CO 和20mol H2,则在平衡状态B时容器的体积V(B)= L。
(3)关于反应CO(g)+2H2(g) CH3OH(g)在化学平衡状态时的描述正确的是 (填字母)。
CH3OH(g)在化学平衡状态时的描述正确的是 (填字母)。
A.CO的含量保持不变 B.容器中CH3OH浓度与CO浓度相等
C.2V正(CH3OH)=V正(H2)D.容器中混合气体的平均相对分子质量保持不变
(4)CO(g)+2H2(g) CH3OH(g),按照相同的物质的量 投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是 。
CH3OH(g),按照相同的物质的量 投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是 。

A.温度:T1 < T2 <T3
B.正反应速率:ν(a)>ν(c); ν(b)>ν(d)
C.平衡常数: K(a) =K(c) ; K(b) >K(d)
D.平均摩尔质量:M(a)<M(c); M(b)>M(d)
(5)已知CO2(g)+H2(g) CO(g)+H2O(g) △H= +
41.3 kJ·mol-1
,试写出由
CO(g)+H2O(g) △H= +
41.3 kJ·mol-1
,试写出由
CO2和H2制取甲醇的热化学方程式 。
查看习题详情和答案>>