摘要:6.下列物质既能通过与Cl2化合反应制取.也能通过与盐酸反应制取的是 A. CuCl2 B . FeCl2 C. FeCl3 D. ZnCl2
网址:http://m.1010jiajiao.com/timu3_id_225963[举报]
小明很喜欢化学实验课,今天要学习“探究铁及其化合物的氧化性或还原性”.
(1)实验前小明预测说:Fe2+肯定既有还原性又有氧化性.你认为他预测的依据是:
(2)小明欲用实验证明他的预测.实验室提供了下列试剂:3%的H2O2溶液、锌粒、铜片、0.1mol?L-1FeCl2溶液、KSCN溶液、新制氯水.
①若小明计划在0.1mol?L-1FeCl2溶液滴入新制氯水,探究Fe2+的还原性,你预计可能发生的反应是:
②实验中,小明发现现象不太明显,老师分析可能是产物的含量太低,建议可以通过检验Fe2+被氧化的产物Fe3+的存在以获取证据.你认为可选
③对于证明Fe2+具有氧化性,小明认为金属单质都具有还原性,并分别将铜片、锌粒投入FeCl2溶液中,结果铜片没变化,锌粒逐渐变小.由此说明三种金属的还原性由强至弱的顺序为:
(3)小明分析H2O2中氧元素显-1价(中间价),并提出疑问:H2O2与FeCl2的反应时,Fe2+还作氧化剂吗?
①请你为小明梳理相关问题:若Fe2+在反应中表现出氧化性应转化成
②实际上Fe2+的还原性较强,实验室的FeCl2溶液常因氧化而变质.除杂的方法是:
查看习题详情和答案>>
(1)实验前小明预测说:Fe2+肯定既有还原性又有氧化性.你认为他预测的依据是:
因为Fe2+中铁元素化合价处于中间价态,可以升高也可以降低
因为Fe2+中铁元素化合价处于中间价态,可以升高也可以降低
.(2)小明欲用实验证明他的预测.实验室提供了下列试剂:3%的H2O2溶液、锌粒、铜片、0.1mol?L-1FeCl2溶液、KSCN溶液、新制氯水.
①若小明计划在0.1mol?L-1FeCl2溶液滴入新制氯水,探究Fe2+的还原性,你预计可能发生的反应是:
Cl2+2Fe2+=2Cl-+2Fe3+
Cl2+2Fe2+=2Cl-+2Fe3+
写离子方程式),可能观察到的现象是:溶液由浅绿色变为黄
黄
色.②实验中,小明发现现象不太明显,老师分析可能是产物的含量太低,建议可以通过检验Fe2+被氧化的产物Fe3+的存在以获取证据.你认为可选
硫氰酸钾溶液
硫氰酸钾溶液
(填名称)滴入小明所得的混合液中,并通过溶液出现血红
血红
色的现象,证明小明的观点和实验方案都是正确的.③对于证明Fe2+具有氧化性,小明认为金属单质都具有还原性,并分别将铜片、锌粒投入FeCl2溶液中,结果铜片没变化,锌粒逐渐变小.由此说明三种金属的还原性由强至弱的顺序为:
Zn Fe Cu
Zn Fe Cu
.(3)小明分析H2O2中氧元素显-1价(中间价),并提出疑问:H2O2与FeCl2的反应时,Fe2+还作氧化剂吗?
①请你为小明梳理相关问题:若Fe2+在反应中表现出氧化性应转化成
Fe
Fe
(填微粒符号,下同),若Fe2+在反应中表现出还原性应转化成Fe3+
Fe3+
.②实际上Fe2+的还原性较强,实验室的FeCl2溶液常因氧化而变质.除杂的方法是:
加入适量铁粉
加入适量铁粉
,相关反应的离子方程式:2Fe3++Fe=3Fe2+
2Fe3++Fe=3Fe2+
.(2013?金华模拟)对化学反应的研究需要从反应条件、限度、速率、定量关系等因素进行综合分析.下列是关于化学反应的系列研究,请根据相关信息回答问题.
I.关于反应物之间的定量关系的研究:
(1)已知反应:2I-+2Fe3+=I2+2Fe2+,向100mL,0.1moL?L-1的FeI2溶液中通入0.01mol Cl2,该反应的离子方程式为
(2)298K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,将物质的量浓度均为2×10-4mol?L-1的氯化镁溶液和氢氧化钠溶液等体积混合,能否产生氢氧化镁沉淀?
Ⅱ,关于反应速率、限度的研究:
近段时间,全国范围内的雾霾天气严重影响了人们的身体健康.环境问题越来越受到人们的重视.汽车尾气中含有较多的NO和CO,两种气体均会使人体中毒.以CO为例,其中毒原理是相同温度下CO与血红蛋白的结合能力远远大于氧气与血红蛋白的结合能力,反应如下:CO+HbO2?O2+HbCO(HbO2表示氧合血红蛋白).
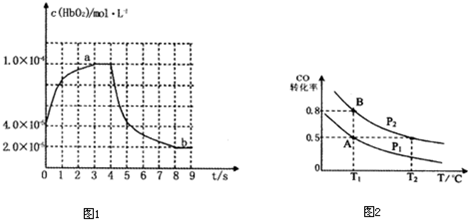
如图表示HbO2浓度随时间的变化:曲线a表示向血样中通入氧气后的变化;曲线b表示在第4s时通入CO和O2混合气体后的变化.
(3)前3s以HbO2表示的平均反应速率为
(4)37℃时,CO+HbO2?O2+HbCO,该反应的平衡常数K=220,资料显示HbCO的浓度达到HbO2浓度的0.022倍,就会导致人体智力受损.据此,通过计算可知,当吸入的CO与O2浓度之比大于或等于
时,人的智力将会受到伤害.
(5)一氧化碳、氢气既是重要的能源,也可以催化还原NO等消除污染,还可以在一定条件下制取CH3OH.已知
N2(g)+O2(g)=2NO((g)△H=+180.5kJ?mol-1
2H2(g)+O2(g)=2H2O(1)△H=-571.6kJ?mol-1
H2O(g)=H2O(1)△H=-44kJ?mol-1
写出H2与NO反应生成N2和水蒸气的热化学方程式
(6)在一容积可变的密闭容器中充入10mol CO和20molH2,在催化剂存在时反应生成甲醇:CO(g)+2H2(g)?CH3OH(g),CO的平衡转化率随温度(T)、压强(P)的变化如右图所示,当达到平衡状态A时,容器的体积为10L.如反应开始时仍充入10mol CO和20mol H2,则在平衡状态B时容器的体积V(B)=
查看习题详情和答案>>
I.关于反应物之间的定量关系的研究:
(1)已知反应:2I-+2Fe3+=I2+2Fe2+,向100mL,0.1moL?L-1的FeI2溶液中通入0.01mol Cl2,该反应的离子方程式为
2I-+Cl2=I2+2Cl-
2I-+Cl2=I2+2Cl-
.(2)298K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,将物质的量浓度均为2×10-4mol?L-1的氯化镁溶液和氢氧化钠溶液等体积混合,能否产生氢氧化镁沉淀?
否
否
(填“能”或“否”).Ⅱ,关于反应速率、限度的研究:
近段时间,全国范围内的雾霾天气严重影响了人们的身体健康.环境问题越来越受到人们的重视.汽车尾气中含有较多的NO和CO,两种气体均会使人体中毒.以CO为例,其中毒原理是相同温度下CO与血红蛋白的结合能力远远大于氧气与血红蛋白的结合能力,反应如下:CO+HbO2?O2+HbCO(HbO2表示氧合血红蛋白).

如图表示HbO2浓度随时间的变化:曲线a表示向血样中通入氧气后的变化;曲线b表示在第4s时通入CO和O2混合气体后的变化.
(3)前3s以HbO2表示的平均反应速率为
2×10-5mol/(L?s)
2×10-5mol/(L?s)
;第9s时,HbCO的浓度为8×10-5
8×10-5
mol?L-1.(4)37℃时,CO+HbO2?O2+HbCO,该反应的平衡常数K=220,资料显示HbCO的浓度达到HbO2浓度的0.022倍,就会导致人体智力受损.据此,通过计算可知,当吸入的CO与O2浓度之比大于或等于
| 1 |
| 10000 |
| 1 |
| 10000 |
(5)一氧化碳、氢气既是重要的能源,也可以催化还原NO等消除污染,还可以在一定条件下制取CH3OH.已知
N2(g)+O2(g)=2NO((g)△H=+180.5kJ?mol-1
2H2(g)+O2(g)=2H2O(1)△H=-571.6kJ?mol-1
H2O(g)=H2O(1)△H=-44kJ?mol-1
写出H2与NO反应生成N2和水蒸气的热化学方程式
2H2(g)+2NO(g)=2H2O(g)+N2(g)△H=-664.1kJ/mol
2H2(g)+2NO(g)=2H2O(g)+N2(g)△H=-664.1kJ/mol
.(6)在一容积可变的密闭容器中充入10mol CO和20molH2,在催化剂存在时反应生成甲醇:CO(g)+2H2(g)?CH3OH(g),CO的平衡转化率随温度(T)、压强(P)的变化如右图所示,当达到平衡状态A时,容器的体积为10L.如反应开始时仍充入10mol CO和20mol H2,则在平衡状态B时容器的体积V(B)=
2
2
L.