摘要: 在酸性和碱性介质中,下列离子都能够大量共存的是 A. Fe2+.K+.SO42-.NO3- B. Mg2+.NH4+.SO42-.Cl- C. Na+.K+.SO42-.NO3- D. Ba2+.Na+.SO42-.MnO4-
网址:http://m.1010jiajiao.com/timu3_id_223855[举报]
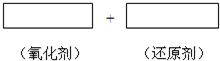 KMnO4的氧化性随pH的减小而增大.其在酸性介质中还原产物是Mn2+;在中性或碱性介质中还原产物主要是MnO2.
KMnO4的氧化性随pH的减小而增大.其在酸性介质中还原产物是Mn2+;在中性或碱性介质中还原产物主要是MnO2.(1)应该在
(2)在亚硫酸溶液中滴入酸性KMnO4溶液.将该反应的氧化剂、还原剂和配平后的系数填入正确位置,并标出电子转移的方向和数目
(3)三氯乙烯(C2HCl3)是地下水有机污染物的主要成分,研究显示在地下水中加入KMnO4溶液可将其中的三氯乙烯除去,氧化产物只有CO2,写出反应的化学方程式
(4)加入过量的KMnO4才能将水中的三氯乙烯彻底除去.已知n(KMnO4):n(C2HCl3)=5:1时,水样中的三氯乙烯基本完全去除.某地下水样品中三氯乙烯的质量浓度为1×10-4g/L,计算每处理1m3该地下水,需KMnO4
金属铝在酸性或碱性溶液中均可与NO3-发生氧化还原反应,转化关系如下:
已知,气体D和F反应可生成盐,气体D和A溶液反应生成白色沉淀.
请回答下列问题:
(1)A和B两溶液混合产生白色沉淀,该白色沉淀的化学式
(2)C、E排入大气中会造成大气污染,在催化剂存在下,D可以将C、E转化为无毒的气态单质,该单质的电子式
 .
.
(3)完成铝在碱性条件下与NO3-反应的离子方程式
(4)除去气体C中的杂质气体E的化学方法:
(5)Al与NO3-在酸性条件下反应,Al与被还原的NO3-的物质的量之比是
查看习题详情和答案>>

已知,气体D和F反应可生成盐,气体D和A溶液反应生成白色沉淀.
请回答下列问题:
(1)A和B两溶液混合产生白色沉淀,该白色沉淀的化学式
Al(OH)3
Al(OH)3
.(2)C、E排入大气中会造成大气污染,在催化剂存在下,D可以将C、E转化为无毒的气态单质,该单质的电子式


(3)完成铝在碱性条件下与NO3-反应的离子方程式
8Al+3NO3-+5OH-+2H2O=8AlO2-+3NH3
8Al+3NO3-+5OH-+2H2O=8AlO2-+3NH3
.(4)除去气体C中的杂质气体E的化学方法:
3NO2+H2O═2HNO3+NO
3NO2+H2O═2HNO3+NO
(用化学方程式表示).(5)Al与NO3-在酸性条件下反应,Al与被还原的NO3-的物质的量之比是
1:1
1:1
.重要的化工原料M(C5H8O4)有特殊的香味,可以利用如图所示生产流程合成.
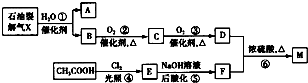
已知:A和B互为同分异构体;X的密度是相同条件下H2密度的21倍;D、F、M均能与NaHCO3?溶液反应生成气体.
(1)A用系统命名法可命名为
(2)X的结构简式:
(3)①~⑥的反应中属于取代反应的有
(4)写出方程式:B→C
(5)M的同分异构体有很多,其中一种同分异构体只含有一种官能团,在酸性和碱性条件下都能水解生成两种有机物,该同分异构体的结构简式是
查看习题详情和答案>>

已知:A和B互为同分异构体;X的密度是相同条件下H2密度的21倍;D、F、M均能与NaHCO3?溶液反应生成气体.
(1)A用系统命名法可命名为
2-丙醇
2-丙醇
.(2)X的结构简式:
CH2=CHCH3
CH2=CHCH3
;E的结构简式:ClCH2COOH
ClCH2COOH
.(3)①~⑥的反应中属于取代反应的有
④⑤⑥
④⑤⑥
.(4)写出方程式:B→C
2CH3CH2CH2OH+O2
2CH3CH2CHO+2H2O
| 催化剂 |
| △ |
2CH3CH2CH2OH+O2
2CH3CH2CHO+2H2O
;D+F→M| 催化剂 |
| △ |
CH3CH2COOH+HOCH2COOH
CH3CH2COOCH2COOH+H2O
| 浓硫酸 |
| △ |
CH3CH2COOH+HOCH2COOH
CH3CH2COOCH2COOH+H2O
.| 浓硫酸 |
| △ |
(5)M的同分异构体有很多,其中一种同分异构体只含有一种官能团,在酸性和碱性条件下都能水解生成两种有机物,该同分异构体的结构简式是
CH3OOCCH2COOCH3或HCOOCH2CH2CH2OOCH或CH3COOCH2OOCCH3
CH3OOCCH2COOCH3或HCOOCH2CH2CH2OOCH或CH3COOCH2OOCCH3
.I.下列实验操作、试剂保存方法和实验室事故处理,一定正确的是
A.不慎将浓碱液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液
B.制备氢氧化铁胶体时,应向沸水中逐滴滴加1~2mL饱和的FeC13溶液,并继续加 热到液体呈透明的红褐色为止
C.测定溶液的pH时,用洁净、干燥的玻璃棒蘸取溶液滴在用蒸馏水湿润过的pH试纸上,并与标准比色卡比较
D.实验室中,浓硝酸保存在带橡胶塞的棕色细口试剂瓶中
E.除去蛋白质溶液中混有的NaC1,可以先加入AgNO3溶液,然后过滤
F.在进行反应热测定时,为保证实验的准确性,我们可以采取以下具体措施:使用碎泡沫以起到隔热保温的作用、使用铜质搅拌棒进行搅拌、使用的酸碱正好反应、进行两到三次实验,取平均值
II.石灰石的主要成分是碳酸钙,含氧化钙约40~50%,较好的石灰石含CaO约45~53%.此外还有SiO2、Fe2O3、Al2O3及MgO等杂质.测定石灰石中钙的含量时将样品溶于盐酸,加入草酸铵溶液,在中性或碱性介质中生成难溶的草酸钙沉淀 (CaC2O4?H2O),将所得沉淀过滤、洗净,用硫酸溶解,用标准高锰酸钾溶液滴定生成的草酸,通过钙与草酸的定量关系,间接求出钙的含量.涉及的化学反应为:H2C2O4+MnO4-+H+→Mn2++CO2↑+H2O(未配平).CaC2O4 沉淀颗粒细小,易沾污,难于过滤.为了得到纯净而粗大的结晶,通常在含Ca2+的酸性溶液中加入饱和 (NH4)2C2O4,由于C2O42-浓度很低,而不能生成沉淀,此时向溶液中滴加氨水,溶液中C2O42-浓度慢慢增大,可以获得颗粒比较粗大的CaC2O4沉淀.沉淀完毕后,pH应在3.5~4.5,这样可避免其他难溶钙盐析出,又不使CaC2O4溶解度太大.根据以上材料回答下列问题:
(1)样品溶于盐酸后得到的沉淀物主要是
(2)沉淀 CaC2O4要加入沉淀剂饱和的 (NH4)2C2O4 溶液,为什么?
(3)工业中通常先用0.1%草酸铵溶液洗涤沉淀,再用冷的蒸馏水洗涤,其目的是:
(4)若开始用去m g样品,最后滴定用去浓度为c mol/L 的KMnO4 溶液V mL,推出CaO含量与 KMnO4的定量计算关系.ω%=
或
%
或
%.
查看习题详情和答案>>
AB
AB
(填序号).A.不慎将浓碱液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液
B.制备氢氧化铁胶体时,应向沸水中逐滴滴加1~2mL饱和的FeC13溶液,并继续加 热到液体呈透明的红褐色为止
C.测定溶液的pH时,用洁净、干燥的玻璃棒蘸取溶液滴在用蒸馏水湿润过的pH试纸上,并与标准比色卡比较
D.实验室中,浓硝酸保存在带橡胶塞的棕色细口试剂瓶中
E.除去蛋白质溶液中混有的NaC1,可以先加入AgNO3溶液,然后过滤
F.在进行反应热测定时,为保证实验的准确性,我们可以采取以下具体措施:使用碎泡沫以起到隔热保温的作用、使用铜质搅拌棒进行搅拌、使用的酸碱正好反应、进行两到三次实验,取平均值
II.石灰石的主要成分是碳酸钙,含氧化钙约40~50%,较好的石灰石含CaO约45~53%.此外还有SiO2、Fe2O3、Al2O3及MgO等杂质.测定石灰石中钙的含量时将样品溶于盐酸,加入草酸铵溶液,在中性或碱性介质中生成难溶的草酸钙沉淀 (CaC2O4?H2O),将所得沉淀过滤、洗净,用硫酸溶解,用标准高锰酸钾溶液滴定生成的草酸,通过钙与草酸的定量关系,间接求出钙的含量.涉及的化学反应为:H2C2O4+MnO4-+H+→Mn2++CO2↑+H2O(未配平).CaC2O4 沉淀颗粒细小,易沾污,难于过滤.为了得到纯净而粗大的结晶,通常在含Ca2+的酸性溶液中加入饱和 (NH4)2C2O4,由于C2O42-浓度很低,而不能生成沉淀,此时向溶液中滴加氨水,溶液中C2O42-浓度慢慢增大,可以获得颗粒比较粗大的CaC2O4沉淀.沉淀完毕后,pH应在3.5~4.5,这样可避免其他难溶钙盐析出,又不使CaC2O4溶解度太大.根据以上材料回答下列问题:
(1)样品溶于盐酸后得到的沉淀物主要是
SiO2
SiO2
(2)沉淀 CaC2O4要加入沉淀剂饱和的 (NH4)2C2O4 溶液,为什么?
保持较大的C2O42-离子浓度,使Ca2+沉淀完全
保持较大的C2O42-离子浓度,使Ca2+沉淀完全
(3)工业中通常先用0.1%草酸铵溶液洗涤沉淀,再用冷的蒸馏水洗涤,其目的是:
降低CaC2O4在水中的溶解度,减少沉淀的损失,降低实验误差
降低CaC2O4在水中的溶解度,减少沉淀的损失,降低实验误差
(4)若开始用去m g样品,最后滴定用去浓度为c mol/L 的KMnO4 溶液V mL,推出CaO含量与 KMnO4的定量计算关系.ω%=
| 0.14CV |
| m |
| 14CV |
| m |
| 0.14CV |
| m |
| 14CV |
| m |
(14分)金属铝在酸性或碱性溶液中均可与NO3-发生氧化还原反应,转化关系如下图所示:

其中,气体D和F反应可生成盐,气体D和A溶液反应生成白色沉淀。
请回答下列问题:
(1)当Al与稀硝酸反应时,稀硝酸表现的性质是
A.只表现强氧化性
B.只表现酸性
C.同时表现强氧化性及酸性
D.表现了强氧化性还表现了还原性
(2)在下列离子方程式的横线上填写产物的化学式(不需要配平)
Al + NO3-+ OH-+ H2O—→ +
(3)过量D的水溶液与A溶液反应的离子方程式是
(4)D—→C反应的化学方程式是
(5)C、E排入大气中会造成大气污染,在催化剂存在下,D可以将C、E转化为无毒的气态单质,该单质是
(6)除去C中的E气体杂质可用的化学方法是:(用化学方程式表示)
(7)Al与NO3-在酸性条件下反应,Al与被还原的NO3-的物质的量之比是 。
查看习题详情和答案>>