摘要: 小小塑料袋.环保大问题.国务院发出通知.要求自2008年6月1日起.在全国范围内禁止生产.销售.使用超薄塑料购物袋.在所有超市.商场等商品零售场所.一律不得免费提供塑料购物袋. (1)下列有关说法中不正确的是 ( ) A.塑料难降解.塑料垃圾会造成“白色污染 B.禁止使用超薄塑料购物袋能有效减少污染 C.回收利用各种废弃塑料制品可以减少“白色污染 D. 将废弃塑料集中到野外焚烧可以减少污染 (2)暑假中的某一天.小明和妈妈到某大型超市购物.发现超市提供的新塑料包装袋与以前的有所不同:①新塑料袋上印有塑料种类和回收标志,②新塑料袋更厚也更结实,③新塑料袋有偿提供.针对上述三个方面的变化.小刚认为从以下几个方面减少了塑料袋的废弃.减轻了“白色污染 :①便于分类回收,②不容易破损.可重复使用,③从节约开支的角度.促使人们少用塑料袋,你认为上述说法正确的是 .在生活中可用 来代替塑料包装袋盛装物品.
网址:http://m.1010jiajiao.com/timu3_id_223842[举报]
| |||||||||||||||||||||
如图表示配制100mL 0.100mol?L-1 Na2CO3溶液的几个关键实验步骤和操作,据图回答下列问题:

(1)若用Na2CO3?10H2O来配制溶液,需要称量晶体
(2)写出配制溶液中所需要用到的玻璃仪器的名称:烧杯、
(3)步骤B通常称为转移,步骤A通常称为
(4)将上述实验步骤A-F按实验过程先后次序排列
查看习题详情和答案>>

(1)若用Na2CO3?10H2O来配制溶液,需要称量晶体
2.9
2.9
克.若所取的晶体已经有一部分失去了结晶水,则所配制的溶液浓度偏大
大
.(填“大/小”).(2)写出配制溶液中所需要用到的玻璃仪器的名称:烧杯、
100mL容量瓶
100mL容量瓶
、玻璃棒、胶头滴管
玻璃棒、胶头滴管
.(3)步骤B通常称为转移,步骤A通常称为
定容
定容
,如果俯视刻度线,配制的浓度将偏大
大
(填大或小).步骤D称为洗涤
洗涤
,若没有步骤D,则配制的浓度偏小
小
.(填“大/小”).(4)将上述实验步骤A-F按实验过程先后次序排列
C、B、D、F、A、E
C、B、D、F、A、E
.能源短缺是人类社会面临的最大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.请回答下面有关甲醇参与反应的有关问题
(1)火力发电厂释放出的氮氧化物(NOx)、二氧化硫和二氧化碳等气体进行脱硝、脱硫和脱碳等处理.可实现绿色环保、节能减排、废物利用等目的.其中,脱碳时将CO2转化为甲醉的热化学方程式为:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H
①取五份等体积CO2和H2的混合气体(物质的傲之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如下图甲所示,则上述CO2转化为甲醇的反应中△H 0(填“>“、“<“或“=“)
②在一恒温恒容(容积为2L)密闭容器中充入2mol CO2和6mol H2,进行上述反应.测得CO2和CH3OH(g)的浓度随时间变化如下图乙所示.试计算:0-10min内,氢气的平均反应速率v(H2)= ;该温度下,反应的平衡常数K=
(2)已知在常温常压下:①2CH3OH(l)+3O2(g)→2C2(g)+4H2O(g)△H=-1275.6kJ/mol
②H2O(g)═H2O(l)△H=-44.0kJ/mol
写出表示甲醉燃烧热的热化学方程式:
(3)某实验小组依据甲醇燃烧的反应原理,设计如下图丙所示的电池装置.
①该电池的正极反应式为 ;负极反应式为
②工作一段时间后,当消耗3.2g甲醇时,同时消耗掉的KOH是 g.

查看习题详情和答案>>
(1)火力发电厂释放出的氮氧化物(NOx)、二氧化硫和二氧化碳等气体进行脱硝、脱硫和脱碳等处理.可实现绿色环保、节能减排、废物利用等目的.其中,脱碳时将CO2转化为甲醉的热化学方程式为:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H
①取五份等体积CO2和H2的混合气体(物质的傲之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如下图甲所示,则上述CO2转化为甲醇的反应中△H
②在一恒温恒容(容积为2L)密闭容器中充入2mol CO2和6mol H2,进行上述反应.测得CO2和CH3OH(g)的浓度随时间变化如下图乙所示.试计算:0-10min内,氢气的平均反应速率v(H2)=
(2)已知在常温常压下:①2CH3OH(l)+3O2(g)→2C2(g)+4H2O(g)△H=-1275.6kJ/mol
②H2O(g)═H2O(l)△H=-44.0kJ/mol
写出表示甲醉燃烧热的热化学方程式:
(3)某实验小组依据甲醇燃烧的反应原理,设计如下图丙所示的电池装置.
①该电池的正极反应式为
②工作一段时间后,当消耗3.2g甲醇时,同时消耗掉的KOH是

我国农业因遭受酸雨而造成的损失每年高达15亿多元,为了有效控制酸雨,目前国务院已批准了《酸雨控制区和二氧化硫污染控制区划分方案》等法规.
(1)现有雨水样品1份,每隔一段时间测定该雨水样品的pH所得数据如下:

分析数据,回答以下问题:
①雨水样品的pH变化的原因(用化学方程式表示):
②如果将刚取样的上述雨水和用氯气消毒后的自来水混合,pH将变
(2)你认为减少酸雨产生的途径可采用的措施是
①少用煤作燃料
②把工厂烟囱造高
③燃烧脱硫
④在已酸化的土壤中加石灰
⑤开发新能源
A.①②③B.②③④⑤
C.①②⑤D.①③⑤
查看习题详情和答案>>
(1)现有雨水样品1份,每隔一段时间测定该雨水样品的pH所得数据如下:

分析数据,回答以下问题:
①雨水样品的pH变化的原因(用化学方程式表示):
2H2SO3+O2=2H2SO4
2H2SO3+O2=2H2SO4
②如果将刚取样的上述雨水和用氯气消毒后的自来水混合,pH将变
小
小
.(填“大”、“小”、“不变”)(2)你认为减少酸雨产生的途径可采用的措施是
D
D
.①少用煤作燃料
②把工厂烟囱造高
③燃烧脱硫
④在已酸化的土壤中加石灰
⑤开发新能源
A.①②③B.②③④⑤
C.①②⑤D.①③⑤
有人设计了一种乙醇燃料电池,一个电极通入空气,另一个电极通入乙醇蒸汽.电池的固定电解质是晶格掺杂了Y2O3的ZrO2固体,它在高温下能传导O2-离子.
(1)该电极负极发生的反应是
(2)乙醇的制备可以用CO2和氢气为原料,在催化剂作用下发生如下反应,
2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95ⅹ1011
CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95ⅹ1011
①写出反应的平衡常数表达式K=
.
②1m3(标准状况)CO2按上式完全反应,产生CH3CH2OH
③在一定压强下,n(H2)/n(CO2)=2,测得反应的实验数据如下表:
根据表中数据分析:
ⅰ.该反应是
ⅱ.提高
的值,K值
ⅲ.如图是某条件下H2的浓度随时间的变化曲线,若增大压强,其他条件不变,请在原图中画出H2的浓度随时间的变化曲线.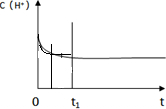

(3)有人认为乙醇的来源成本比较高,为降低成本,可以设计汽油燃料电池,但却存在一个最大问题,你认为该问题是
查看习题详情和答案>>
(1)该电极负极发生的反应是
C2H5OH-12e-=2CO2+3H2O
C2H5OH-12e-=2CO2+3H2O
.固体电解质中的O2-向负
负
极方向移动.(2)乙醇的制备可以用CO2和氢气为原料,在催化剂作用下发生如下反应,
2CO2(g)+6H2(g)
 CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95ⅹ1011
CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95ⅹ1011①写出反应的平衡常数表达式K=
| c(CH3CH2OH)×c3(H2O) |
| c2(CO2)×c6(H2) |
| c(CH3CH2OH)×c3(H2O) |
| c2(CO2)×c6(H2) |
②1m3(标准状况)CO2按上式完全反应,产生CH3CH2OH
22.3
22.3
mol.③在一定压强下,n(H2)/n(CO2)=2,测得反应的实验数据如下表:
| 温度(K) | 500 | 600 | 700 | 800 |
| CO2转化率(%) | 60 | 43 | 28 | 15 |

ⅰ.该反应是
放热
放热
反应(填“放热”或“吸热”),升高温度,平衡常数K值减小
减小
(填“增大”、“减小”或“不变”).ⅱ.提高
| n(H2) |
| n(CO2) |
不变
不变
(填“增大”、“减小”或“不变”),对生产乙醇有利
有利
(填“有利”或“不利”).ⅲ.如图是某条件下H2的浓度随时间的变化曲线,若增大压强,其他条件不变,请在原图中画出H2的浓度随时间的变化曲线.


(3)有人认为乙醇的来源成本比较高,为降低成本,可以设计汽油燃料电池,但却存在一个最大问题,你认为该问题是
电极的气体管道溶液被堵塞
电极的气体管道溶液被堵塞
.造成这种问题的主要原因是汽油不完全燃烧产生碳黑
汽油不完全燃烧产生碳黑
.