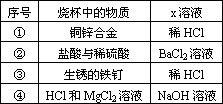
网址:http://m.1010jiajiao.com/timu3_id_223835[举报]
 实验室中可用盐酸滴定的方法测定Na2CO3或NaHCO3的含量.测定Na2CO3时,若用酚酞作指示剂,逐滴加入盐酸至溶液由红色变无色时,Na2CO3完全转化为NaHCO3;测定NaHCO3时,若用甲基橙作指示剂,逐滴加入盐酸至溶液由黄色变橙色时NaHCO3完全转化为CO2逸出.
实验室中可用盐酸滴定的方法测定Na2CO3或NaHCO3的含量.测定Na2CO3时,若用酚酞作指示剂,逐滴加入盐酸至溶液由红色变无色时,Na2CO3完全转化为NaHCO3;测定NaHCO3时,若用甲基橙作指示剂,逐滴加入盐酸至溶液由黄色变橙色时NaHCO3完全转化为CO2逸出.(1)写出Na2CO3完全转化为NaHCO3的离子方程式
(2)某天然碱的化学式为xNa2CO3?NaHCO3?2H2O,为了测定其组成,取0.3320g样品于锥形瓶中,加适量蒸馏水使之溶解,加入几滴酚酞,用0.1000mol?L-1的盐酸滴定至溶液由红色变无色,消耗盐酸20.00mL;再向已变无色的溶液中加入几滴甲基橙,继续用该盐酸滴定至溶液由黄色变橙色,又消耗盐酸30.00mL.
①实验时用到的玻璃仪器有烧杯、胶头滴管、锥形瓶、
②该天然碱化学式中x=
(3)某学习小组在实验室中制备Na2CO3,假设产品中含有少量NaCl、NaHCO3杂质,设计实验方案进行检验,完成下表.
限选试剂:0.1000mol?L-1盐酸、稀硝酸、AgNO3溶液、酚酞、甲基橙、蒸馏水.
| 实验步骤 | 结果分析 |
| 步骤①:取少量样品于试管中,加入适量蒸馏水使之溶解, |
有白色沉淀生成,说明产品中含有NaC1 |
| 步骤②:另取少量样品于锥形瓶中,加入适量蒸馏水使之溶解,加入几滴酚酞,用0.1000mol?L-1盐酸滴定至溶液由红色变无色,记录消耗盐酸的体积Vl; |
品中含有NaHCO3 |
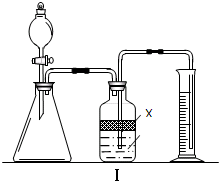
①广口瓶中的试剂X可以选用
A.苯B.酒精C.植物油D.CCl4
②广口瓶的液体没有装满(上方留有少量空间),实验测得二氧化碳的体积将
 实验室中可用盐酸滴定的方法测定Na2CO3或NaHCO3的含量.测定Na2CO3时,若用酚酞作指示剂,逐滴加入盐酸至溶液由红色变无色时,Na2CO3完全转化为NaHCO3;测定NaHCO3时,若用甲基橙作指示剂,逐滴加入盐酸至溶液由黄色变橙色时NaHCO3完全转化为CO2逸出.
实验室中可用盐酸滴定的方法测定Na2CO3或NaHCO3的含量.测定Na2CO3时,若用酚酞作指示剂,逐滴加入盐酸至溶液由红色变无色时,Na2CO3完全转化为NaHCO3;测定NaHCO3时,若用甲基橙作指示剂,逐滴加入盐酸至溶液由黄色变橙色时NaHCO3完全转化为CO2逸出.
(1)写出Na2CO3完全转化为NaHCO3的离子方程式______.
(2)某天然碱的化学式为xNa2CO3?NaHCO3?2H2O,为了测定其组成,取0.3320g样品于锥形瓶中,加适量蒸馏水使之溶解,加入几滴酚酞,用0.1000mol?L-1的盐酸滴定至溶液由红色变无色,消耗盐酸20.00mL;再向已变无色的溶液中加入几滴甲基橙,继续用该盐酸滴定至溶液由黄色变橙色,又消耗盐酸30.00mL.
①实验时用到的玻璃仪器有烧杯、胶头滴管、锥形瓶、______.
②该天然碱化学式中x=______.
(3)某学习小组在实验室中制备Na2CO3,假设产品中含有少量NaCl、NaHCO3杂质,设计实验方案进行检验,完成下表.
限选试剂:0.1000mol?L-1盐酸、稀硝酸、AgNO3溶液、酚酞、甲基橙、蒸馏水.
| 实验步骤 | 结果分析 |
| 步骤①:取少量样品于试管中,加入适量蒸馏水使之溶解, ______ | 有白色沉淀生成,说明产品中含有NaC1 |
| 步骤②:另取少量样品于锥形瓶中,加入适量蒸馏水使之溶解,加入几滴酚酞,用0.1000mol?L-1盐酸滴定至溶液由红色变无色,记录消耗盐酸的体积Vl;______,记录消耗盐酸的体积V2 | ______,说明产 品中含有NaHCO3 |
①广口瓶中的试剂X可以选用______.
A.苯B.酒精C.植物油D.CCl4
②广口瓶的液体没有装满(上方留有少量空间),实验测得二氧化碳的体积将______(填“偏高”、“偏低”或“不变”). 查看习题详情和答案>>
(一)氧化铜的制备:
①称取
②向上述溶液中逐滴加入NaOH溶液,直至不再产生沉淀,将所得混合物转移到蒸发皿,加热至沉淀全部变为黑色。
③将步骤②所得混合物过滤、洗涤,晾干后研细备用。
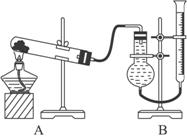
(二)证明氧化铜能加快氯酸钾分解并与MnO2的催化效果比较:
用如上图装置进行实验,所能影响实验的其他因素均已忽略,实验数据如下表:
实验序号 | KClO3质量 | 其他物质质量 | 待测数据 |
④ | 无其他物质 | x | |
⑤ | CuO | y | |
⑥ | MnO2 | z |
试回答如下问题:
(1)上述实验各步骤中需要使用玻璃棒的是________ (填序号)。步骤①③中研磨固体所使用仪器名称是__________________________________________________________________。
(2)步骤③中洗涤沉淀的操作是________________________________________________。
(3)上述实验装置图中量气装置B是由干燥管、乳胶管和50 mL滴定管改造组装而成,此处的滴定管是________ (填“酸式”或“碱式”)滴定管。
(4)除测定出表中“待测数据”外,为探究CuO在实验⑤中是否起催化作用,需补做如下实验(具体操作不需写出)。
a.________;b.CuO的化学性质有没有改变。
(5)表中的“待测数据”x、y、z指________。
查看习题详情和答案>>(一)氧化铜的制备:
①称取2.5克CuSO4·5H2O晶体研细后倒入烧杯,加10 mL蒸馏水溶解。
②向上述溶液中逐滴加入NaOH溶液,直至不再产生沉淀,将所得混合物转移到蒸发皿,加热至沉淀全部变为黑色。
③将步骤②所得混合物过滤、洗涤,晾干后研细备用。

(二)证明氧化铜能加快氯酸钾分解并与MnO2的催化效果比较:
用如图装置进行实验,所能影响实验的其他因素均已忽略,实验数据如下表:
实验序号 | KclO3质量 | 待测数据 |
|
④ | 1.25g | 无其他物质 | X |
⑤ | 1.25g | CuO 0.5g | Y |
⑥ | 1.25g | MnO2 0.5g | Z |
试回答如下问题:
(1)上述实验各步骤中需要使用玻璃棒的是________(填序号)。步骤①③中研磨固体所使用仪器名称是________________。
(2)步骤③中洗涤沉淀的操作是:___________________________________________________。
(3)上述实验装置图中量气装置B是由干燥管、乳胶管和50 mL滴定管改造组装而成,此处的滴定管是________(填“酸式”或“碱式”)滴定管。
(4)除测定出表中“待测数据”外,为探究CuO在实验⑤中是否起催化作用,需补做如下实验(具体操作不需写出)。
a.________________;b.CuO的化学性质有没有改变。
(5)表中的“待测数据”x、y、z指________________。
查看习题详情和答案>>