摘要:(1)除铁粉中少量的氧化铝 , (2)出去碳酸氢钾溶液中少量的碳酸钾 , (3)除去二氧化硅中少量的氧化钙 , (4)除去氯气中少量的氯化氢气体 .22.中国目前所藏最早的玻璃制品是战国时代的遗物.玻璃与人们的生产生活密切联系. (1)一般住宅的窗玻璃是普通玻璃.工业上将纯碱(Na2CO3).石灰石(CaCO3)和石英(SiO2)粉碎后放入玻璃窑中在高温下反应生成玻璃.普通玻璃的主要成分为 . (2)在玻璃中加入某些金属氧化物.可以制成彩色玻璃.如加入Co2O3的玻璃呈蓝色.日常生活中见到的普通玻璃一般呈淡绿色.其原因是原料中混有 的缘故. (3)某玻璃中含Na2O.CaO.SiO2的质量之比为31︰28︰180.此玻璃的组成为 . A.Na2O·CaO·6H2SiO3 B.Na2O·CaO·6SiO2 C.2Na2O·2CaO·9SiO2 D.6Na2O·6CaO·SiO2
网址:http://m.1010jiajiao.com/timu3_id_222804[举报]
写出完成下列实验选用的试剂的名称:
(1)除铁粉中少量的氧化铝______ __;
(2)出去碳酸氢钾溶液中少量的碳酸钾_____________;
(3)除去二氧化硅中少量的氧化钙 ;
(4)除去氯气中少量的氯化氢气体 。
查看习题详情和答案>>写出完成下列实验选用的试剂的名称.
(1)除去乙烷中的少量乙烯;______
(2)除去铁粉中的少量铝粉;______
(3)除去碳酸氢钠溶液中混有的少量碳酸钠;______
(4)除去氯化铁溶液中的氯化亚铁;______
(5)除去二氧化硅中的少量碳酸钙;______.
查看习题详情和答案>>
(1)除去乙烷中的少量乙烯;______
(2)除去铁粉中的少量铝粉;______
(3)除去碳酸氢钠溶液中混有的少量碳酸钠;______
(4)除去氯化铁溶液中的氯化亚铁;______
(5)除去二氧化硅中的少量碳酸钙;______.
写出完成下列实验选用的试剂的名称.
(1)除去乙烷中的少量乙烯;
(2)除去铁粉中的少量铝粉;
(3)除去碳酸氢钠溶液中混有的少量碳酸钠;
(4)除去氯化铁溶液中的氯化亚铁;
(5)除去二氧化硅中的少量碳酸钙;
查看习题详情和答案>>
(1)除去乙烷中的少量乙烯;
溴水
溴水
(2)除去铁粉中的少量铝粉;
氢氧化钠溶液
氢氧化钠溶液
(3)除去碳酸氢钠溶液中混有的少量碳酸钠;
二氧化碳
二氧化碳
(4)除去氯化铁溶液中的氯化亚铁;
氯气
氯气
(5)除去二氧化硅中的少量碳酸钙;
盐酸
盐酸
.(1)保证食品安全、保持营养均衡,是人体健康的基础.
①餐饮业产生的“地沟油”的主要成分是油脂.一定条件下,油脂水解可以生成高级脂肪酸和
②若人体内缺乏铁元素,人就会患的疾病是缺铁性贫血,血液输送
③下列营养素中,不能对人体提供能量的是
A.维生素 B.糖类 C.蛋白质
④人体内缺乏某种维生素会引起坏血病,这种维生素是
⑤氨基酸是组成蛋白质的基本结构单元,其分子中一定含有的官能团是氨基(-NH2)和
⑥淀粉在淀粉酶的作用下最终水解为葡萄糖(C6H12O6),写出相应的化学方程式:
(2)下列是生活常用的物质:
A.碳酸氢钠 B.青霉素 C葡萄糖D.苯甲酸钠 E.柠檬黄
①可用作食品着色剂的是
②可直接进入血液补充能量的是
③可用作食品防腐剂的是
④属于抗生素的是
⑤治疗胃酸过多的是
(3)采取适当的措施能减少对环境的污染.
①对汽车加装尾气催化净化装置,使其中的有害气体NO、CO转化为无害气体,该反应的化学方程式为
②天然水中含有的细小悬浮颗粒可以用
查看习题详情和答案>>
①餐饮业产生的“地沟油”的主要成分是油脂.一定条件下,油脂水解可以生成高级脂肪酸和
甘油
甘油
.②若人体内缺乏铁元素,人就会患的疾病是缺铁性贫血,血液输送
氧
氧
的能力下降.③下列营养素中,不能对人体提供能量的是
A
A
.(填字母)A.维生素 B.糖类 C.蛋白质
④人体内缺乏某种维生素会引起坏血病,这种维生素是
维生素C
维生素C
(填“维生素A”或“维生素C”).⑤氨基酸是组成蛋白质的基本结构单元,其分子中一定含有的官能团是氨基(-NH2)和
-COOH
-COOH
(写结构简式).人体中共有二十多种氨基酸,其中人体自身不能
不能
(填“能”或“不能”)合成的氨基酸称为人体必需氨基酸.⑥淀粉在淀粉酶的作用下最终水解为葡萄糖(C6H12O6),写出相应的化学方程式:
(C6H10O5)n+nH2O
nC6H12O6
| 催化剂 |
(C6H10O5)n+nH2O
nC6H12O6
.| 催化剂 |
(2)下列是生活常用的物质:
A.碳酸氢钠 B.青霉素 C葡萄糖D.苯甲酸钠 E.柠檬黄
①可用作食品着色剂的是
E
E
(填字母,下同);②可直接进入血液补充能量的是
C
C
;③可用作食品防腐剂的是
D
D
;④属于抗生素的是
B
B
;⑤治疗胃酸过多的是
A
A
.(3)采取适当的措施能减少对环境的污染.
①对汽车加装尾气催化净化装置,使其中的有害气体NO、CO转化为无害气体,该反应的化学方程式为
2NO+2CO
N2+2CO2
| ||
2NO+2CO
N2+2CO2
.
| ||
②天然水中含有的细小悬浮颗粒可以用
明矾(或聚合氯化铝或硫酸亚铁等)
明矾(或聚合氯化铝或硫酸亚铁等)
做混凝剂(写名称)进行净化处理.工业废水中含有的Cr3+离子,可用熟石灰作沉淀剂,在pH为8~9时生成沉淀而除去,该反应的离子方程式是Cr3++3OHˉ=Cr(OH)3↓
Cr3++3OHˉ=Cr(OH)3↓
.可用漂白粉对天然水进行消毒,漂白粉的有效成分是Ca(ClO)2
Ca(ClO)2
(填化学式).重铬酸钾(K2Cr2O7)是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO?Cr2O3)为原料生产重铬酸钾.实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如图所示.反应器中涉及的主要反应是:
6FeO?Cr2O3+24NaOH+7KClO3
12Na2CrO4+3Fe2O3+7KCl+12H2O
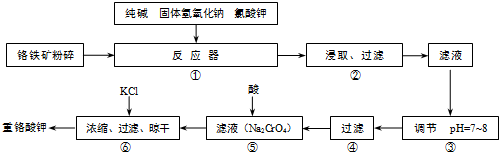
试回答下列问题:
(1)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应的原理相同均转变为可溶性盐.写出氧化铝与碳酸钠反应的化学方程式: .
(2)操作⑤中加酸酸化后CrO42-转化为Cr2O72-,写出转化的离子方程式: .
(3)步骤③中测定pH值的操作为: .
(4)某同学设计的检验上述工艺流程④的滤渣中Fe、Al、Si元素成分的探究实验如下,请帮助完成该实验,并填写表中空格:
(5)称取重铬酸钾(其式量为294)试样2.5000g配成250mL溶液,用移液管取出25.00mL于碘量瓶中,加入10mL 2mol/L H2SO4和足量碘化钾(铬的还原产物为Cr3+),放置于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/L Na2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-).
①配制溶液时所需的玻璃仪器除烧杯、玻璃棒外,还需 和 .
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品中重铬酸钾的纯度为(设整个过程中其他杂质不参与反应) .(保留2位小数)
查看习题详情和答案>>
6FeO?Cr2O3+24NaOH+7KClO3
| ||

试回答下列问题:
(1)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应的原理相同均转变为可溶性盐.写出氧化铝与碳酸钠反应的化学方程式:
(2)操作⑤中加酸酸化后CrO42-转化为Cr2O72-,写出转化的离子方程式:
(3)步骤③中测定pH值的操作为:
(4)某同学设计的检验上述工艺流程④的滤渣中Fe、Al、Si元素成分的探究实验如下,请帮助完成该实验,并填写表中空格:
| 操作步骤 | 实验现象 | 结论 |
| ①取滤渣样少量于试管中,加足量稀HCl,搅拌,静置. | 试管中仍有固体物质 | 固体为 |
| ②操作①后,过滤;在滤液中加入过量的 |
有红褐色沉淀产生 | 沉淀为Fe(OH)3 |
| ③将操作②后的红褐色沉淀滤去,在滤液中通入足量CO2. | 生成物为Al(OH)3 |
①配制溶液时所需的玻璃仪器除烧杯、玻璃棒外,还需
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品中重铬酸钾的纯度为(设整个过程中其他杂质不参与反应)