网址:http://m.1010jiajiao.com/timu3_id_218631[举报]
复印机使用的墨粉主要成分是Fe3O4,下图是氧化沉淀![]() 法生产Fe3O4的工艺:
法生产Fe3O4的工艺:
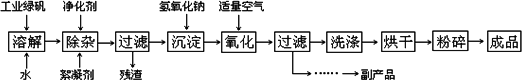
已知:①工业绿矾中FeSO4的含量为52.5%,其中的杂质不参与反应;
②Fe(OH)2+2Fe(OH)3=Fe3O4·4H2O
③12.16﹡1000﹡
52.5%=6384,6384/152=42请回答下列问题:(1)铁的常见氧化物有________;
(2)Fe3O4与稀硝酸反应的离子方程式是________,检验反应后的溶液中含Fe3+的方法________;
(3)在工艺流程中,通入适量空气“氧化”时的化学方程式是:
________;(4)生产中可获得的副产品是
________,提取该副产品的操作顺序是________(填写序号)a.过滤
b.加热浓缩
c.冷却
d.结晶
e
.洗涤(5)在生产过程中,若工业绿矾的投料速率是12.16 kg/h,为使产品较纯,鼓入空气的速率应为
________L/h(假设反应在标准状态下进行,空气中O2占20%).步骤1(浸取):称取50克干燥的茶叶,研碎,置于大烧杯中加水煮沸15~20分钟后,过滤,弃去茶叶渣。向滤液中加入适量熟石灰,过滤 ,弃去滤渣。
步骤2(提纯):将滤液转移至蒸发皿中,浓缩至30 mL;冷却;转移至某仪器中;加入氯仿15 mL,分离弃去水层。将氯仿层转入蒸馏烧瓶中,水浴蒸馏,再转入小烧杯中,水浴蒸去氯仿,得到咖啡因粗品。
步骤3(称量):称量步骤2的产品。读数如图所示。

(2)步骤 1中,过滤操作中所需要的玻璃仪器有____________________。
(3)步骤1中,加入熟石灰的作用是_______。可以代替熟石灰的试剂是__________。
A.Na2SO4 B.Na2CO3 C.Ba(OH)2 D.生石灰
(4)步骤2中,“某仪器”为_________,“将氯仿层转入蒸馏烧瓶,水浴蒸馏”的目的是_____________。
(5)请计算样品中咖啡因的含量__________________。
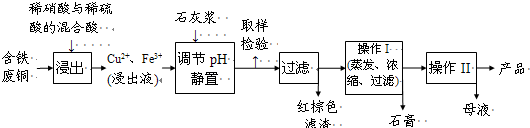
胆矾和石膏在不同温度下的溶解度(g/100g水)见下表.
| 温度(℃) | 20 | 40 | 60 | 80 | 100 |
| 石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
| 胆矾 | 32 | 44.6 | 61.8 | 83.8 | 114 |
(1)红棕色滤渣的主要成分是
(2)写出浸出过程中生成硫酸铜的化学方程式
(3)操作I的操作温度应该控制在
(4)从溶液中分离出硫酸铜晶体的操作II应为
(5)取样检验是为了确认Fe3+是否除净.有同学设计了以下两种方案,在实验室分别对所取样品按下列方案进行操作:
方案一:取样于试管→滴加KSCN溶液;
方案二:径向层析→喷KSCN溶液
①你认为上述两种方案设计更合理的是
②指出你认为不合理的方案存在的问题
(6)反应产物中的NO可以循环使用,用化学方程式表示循环使用的方案
II.(12分)复印机使用的墨粉主要成份是Fe3O4,图是氧化沉淀法生产Fe3O4的工艺:
已知:
①工业绿矾中FeSO4的含量为52.5%,其中的杂质不参与反应;
②Fe(OH)2+2Fe(OH)3═Fe3O4?4H2O
请回答下列问题:
(1)铁的常见氧化物有
(2)Fe3O4与盐酸反应的化学方程式是:
(3)在工艺流程中,通入适量空气“氧化”时的化学方程式是:
(4)生产中可获得的副产品是
a.过滤 b.加热浓缩 c.冷却 d.结晶 e.洗涤
(5)在生产过程中,若工业绿矾的投料速率是12.16kg/h,为使产品较纯,鼓入空气的速率应为
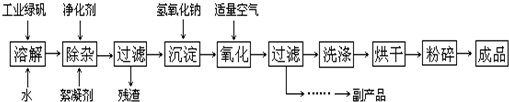
(14分) 复印机使用的墨粉主要成分是Fe3O4,下图是氧化沉淀法生产Fe3O4的工艺:
已知:①工业绿矾中FeSO4的含量为52.5%,其中的杂质不参与反应;
② Fe(OH)2+2Fe(OH)3=Fe3O4·4H2O
③ 12.16﹡1000﹡52.5%=6384, 6384/152=42请回答下列问题:
(1)铁的常见氧化物有 ;
(2)Fe3O4与稀硝酸反应的离子方程式是 ,检验反应后的溶液中含Fe3+的方法 ;
(3)在工艺流程中,通入适量空气“氧化”时的化学方程式是: ;
(4)生产中可获得的副产品是 ,提取该副产品的操作顺序是 (填写序号)
a.过滤 b.加热浓缩 c.冷却 d.结晶 e.洗涤
(5)在生产过程中,若工业绿矾的投料速率是12.16 kg/h,为使产品较纯,鼓入空气的速率应为 L/h(假设反应在标准状态下进行,空气中O2占20%)。
查看习题详情和答案>>
(14分). 复印机使用的墨粉主要成分是Fe3O4,下图是氧化沉淀法生产Fe3O4的工艺:
已知:① 工业绿矾中FeSO4的含量为52.5%,其中的杂质不参与反应;
② Fe(OH)2+2Fe(OH)3=Fe3O4·4H2O
③ 12.16﹡1000﹡52.5%=6384, 6384/152=42请回答下列问题:
(1)铁的常见氧化物有 ;
(2)Fe3O4与稀硝酸反应的离子方程式是 ,检验反应后的溶液中含Fe3+的方法 ;
(3)在工艺流程中,通入适量空气“氧化”时的化学方程式是: ;
(4)生产中可获得的副产品是 ,提取该副产品的操作顺序是 (填写序号)
a.过滤 b.加热浓缩 c.冷却 d.结晶 e.洗涤
(5)在生产过程中,若工业绿矾的投料速率是12.16 kg/h,为使产品较纯,鼓入空气的速率应为 L/h(假设反应在标准状态下进行,空气中O2占20%)。
查看习题详情和答案>>