摘要:23.干燥剂“碱石灰 是氧化钙和氢氧化钠的混合物.在空气中容易变质.某研究小组对一只干燥管里的“碱石灰 样品的成分进行实验探究. [提出猜想] 猜想Ⅰ:没有变质.只含有氧化钙和氢氧化钠. 猜想Ⅱ:部分变质.含有-- 猜想Ⅲ:完全变质.只含有碳酸钙.碳酸钠. [实验探究] 操作 现象 结论 试管外壁发烫.得到浑浊的液体. 推测样品中含有 滤渣溶解.产生大量气泡. 写出产生大量气泡的化学方程式: 产生白色沉淀. 写出产生白色沉淀的化学方程式: [小结与思考] ⑴从上述实验现象推断:猜想 成立. ⑵“碱石灰 样品里是否一定含有碳酸钙?请说明理由. .
网址:http://m.1010jiajiao.com/timu3_id_21688[举报]
 干燥剂“碱石灰”是氧化钙和氢氧化钠的混合物,在空气中容易变质.某研究小组对一只干燥管里的“碱石灰”样品的成分进行实验探究.
干燥剂“碱石灰”是氧化钙和氢氧化钠的混合物,在空气中容易变质.某研究小组对一只干燥管里的“碱石灰”样品的成分进行实验探究.[提出猜想]
猜想Ⅰ:没有变质,只含有氧化钙和氢氧化钠.
猜想Ⅱ:部分变质,含有…
猜想Ⅲ:完全变质,只含有碳酸钙、碳酸钠.
[实验探究]
| 操作 | 现象 | 结论 |
① |
试管外壁发烫,得到浑浊的液体 | 推测样品中含有 氧化钙和氢氧化钠至少有一个 氧化钙和氢氧化钠至少有一个 |
②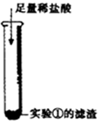 |
滤渣溶解,产生大量气泡 | 写出产生大量气泡的化学方程式 CaCO3+2HCl=CaCl2+H2O+CO2↑ CaCO3+2HCl=CaCl2+H2O+CO2↑ |
③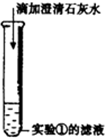 |
产生白色沉淀 | 写出产生白色沉淀的化学方程式 Ca(OH)2+Na2CO3=CaCO3↓+2NaOH Ca(OH)2+Na2CO3=CaCO3↓+2NaOH |
(1)从上述实验现象推断:猜想
II
II
成立.(2)“碱石灰”样品里是否一定含有碳酸钙?
不一定
不一定
(填“一定”或“不一定”),请说明理由.若碱石灰中同时有Ca(OH)2和Na2CO3加水后也会得到碳酸钙
若碱石灰中同时有Ca(OH)2和Na2CO3加水后也会得到碳酸钙
.(3)能用碱石灰干燥的气体是
DE
DE
.A.HCl B.CO2 C.SO2 D.NH3 E.O2.
干燥剂“碱石灰”是氧化钙和氢氧化钠的混合物,在空气中容易变质.某研究小组对一只干燥管里的“碱石灰”样品的成分进行实验探究.
[提出猜想]
猜想Ⅰ:没有变质,只含有氧化钙和氢氧化钠.
猜想Ⅱ:部分变质,含有…
猜想Ⅲ:完全变质,只含有碳酸钙、碳酸钠.
[实验探究]
[小结与思考]
(1)从上述实验现象推断:猜想______成立.
(2)“碱石灰”样品里是否一定含有碳酸钙?______(填“一定”或“不一定”),请说明理由.______.
(3)能用碱石灰干燥的气体是______.
A.HCl B.CO2 C.SO2 D.NH3 E.O2.
 查看习题详情和答案>>
查看习题详情和答案>>
[提出猜想]
猜想Ⅰ:没有变质,只含有氧化钙和氢氧化钠.
猜想Ⅱ:部分变质,含有…
猜想Ⅲ:完全变质,只含有碳酸钙、碳酸钠.
[实验探究]
| 操作 | 现象 | 结论 |
① | 试管外壁发烫,得到浑浊的液体 | 推测样品中含有______ |
② | 滤渣溶解,产生大量气泡 | 写出产生大量气泡的化学方程式______ |
③ | 产生白色沉淀 | 写出产生白色沉淀的化学方程式______ |
(1)从上述实验现象推断:猜想______成立.
(2)“碱石灰”样品里是否一定含有碳酸钙?______(填“一定”或“不一定”),请说明理由.______.
(3)能用碱石灰干燥的气体是______.
A.HCl B.CO2 C.SO2 D.NH3 E.O2.
 查看习题详情和答案>>
查看习题详情和答案>>
干燥剂“碱石灰”是氧化钙和氢氧化钠的混合物,在空气中容易变质.某研究小组对一只干燥管里的“碱石灰”样品的成分进行实验探究.

[提出猜想]
猜想Ⅰ:没有变质,只含有氧化钙和氢氧化钠.
猜想Ⅱ:部分变质,含有……
猜想Ⅲ:完全变质,只含有碳酸钙、碳酸钠.
[实验探究]
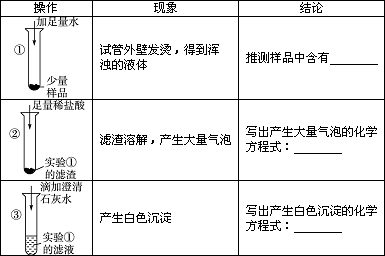
[小结与思考]
(1)从上述实验现象推断:猜想________成立.
(2)“碱石灰”样品里是否一定含有碳酸钙?请说明理由.
________.
干燥剂“碱石灰”是氧化钙和氢氧化钠的混合物,在空气中容易变质.某研究小组对一只干燥管里的“碱石灰”样品的成分进行实验探究.

[提出猜想]
猜想Ⅰ:没有变质,只含有氧化钙和氢氧化钠.
猜想Ⅱ:部分变质,含有……
猜想Ⅲ:完全变质,只含有碳酸钙、碳酸钠.
[实验探究]
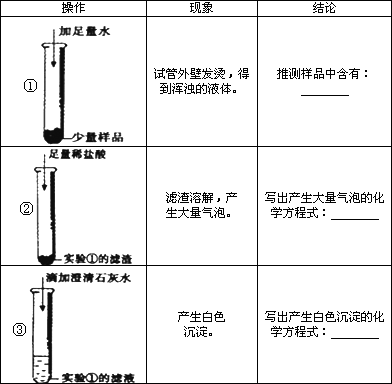
[小结与思考]
(1)从上述实验现象推断:猜想________成立.
(2)“碱石灰”样品里是否一定含有碳酸钙?请说明理由.
___________________.
碱石灰是氧化钙和氢氧化钠的固体混合物,是实验室常用的干燥剂.某研究性
学习小组对在空气中长期露置已变质的碱石灰样品进行如下探究.
Ⅰ.定性探究
[提出问题]碱石灰样品中可能含有哪些物质?
[猜 想]猜想一:可能含有Na2C03,作出此猜想的依据是
猜想二:可能含有Ca(OH)2,作出此猜想的依据是
[设计实验]
[提示]Na2C03和 Ca(OH)2溶于水均无明显热量变化.
[交流与讨论]
(1)小鹏同学提出:“步骤①中形成浊液,说明样品中含有碳酸钙”,你认为他的观点
(2)小虎同学认为本实验设计中,碱石灰样品中是否有CaC03是无法证明的.于是他和小兰,小娟认真探究,设计出了判断是否有CaC03的实验方案:他(她)们取几大块已变质的碱石灰样品,从表面刮取一定量的固体,进行
Ⅱ.定量探究
[提出问题]样品中碳酸钠的质量分数的最大值是多少呢?小娟同学设计了以下方案:

则样品中Na2C03的质量分数的最大值是多少?(写出计算过程)
[交流与反思]
小兰同学认为小娟同学得到的计算结果不准确.因为稀盐酸有挥发性,可能导致测得的碳酸钠的质量分数偏大.由于挥发量不大,可以忽略不计.
查看习题详情和答案>>
学习小组对在空气中长期露置已变质的碱石灰样品进行如下探究.
Ⅰ.定性探究
[提出问题]碱石灰样品中可能含有哪些物质?
[猜 想]猜想一:可能含有Na2C03,作出此猜想的依据是
CO2+2NaOH=Na2CO3+H2O
CO2+2NaOH=Na2CO3+H2O
(用化学方程式表示).猜想二:可能含有Ca(OH)2,作出此猜想的依据是
氧化钙吸收水生成氢氧化钙
氧化钙吸收水生成氢氧化钙
(用简洁的文字表述).[设计实验]
| 实验步骤 | 实验现象 | 解释或结论 |
| ①取适量样品置于试管中,加足量的水溶解,观察并用手触摸试管外壁 | 形成浊液 试管外壁发热 |
则样品中CaO 和 Ca(OH)2、CaCO3 Ca(OH)2、CaCO3 至少有一种 |
| ②将①的浊液过滤,向所得的滤液中逐滴加入氯化钙溶液至过量 | 产生白色沉淀 |
样品中含有的物质是 Na2CO3 Na2CO3 |
| ③将②的浊液过滤,向所得的滤液中滴加几滴酚酞溶液 | 溶液 变成红色 变成红色 |
由步骤①可知:最后滤液一定显碱性, 因此无法检验样品中的Ca(OH)2 |
[交流与讨论]
(1)小鹏同学提出:“步骤①中形成浊液,说明样品中含有碳酸钙”,你认为他的观点
不正确
不正确
(填“正确”或“不正确”).(2)小虎同学认为本实验设计中,碱石灰样品中是否有CaC03是无法证明的.于是他和小兰,小娟认真探究,设计出了判断是否有CaC03的实验方案:他(她)们取几大块已变质的碱石灰样品,从表面刮取一定量的固体,进行
高温煅烧
高温煅烧
(操作方法),再将产生的气体通入澄清的石灰水,变浑浊,证明样品中有碳酸钙(提示:碳酸钠高温不分解).Ⅱ.定量探究
[提出问题]样品中碳酸钠的质量分数的最大值是多少呢?小娟同学设计了以下方案:

则样品中Na2C03的质量分数的最大值是多少?(写出计算过程)
[交流与反思]
小兰同学认为小娟同学得到的计算结果不准确.因为稀盐酸有挥发性,可能导致测得的碳酸钠的质量分数偏大.由于挥发量不大,可以忽略不计.