摘要:⑴2H2 (g) + O2 (g) = 2H2O(l) △H =-571.6 kJ •mol-1 . ⑵ CH4(g) + 2O2 (g) =CO2(g)+ 2H2O(l) △H =-890kJ •mol-1
网址:http://m.1010jiajiao.com/timu3_id_215077[举报]
联合国气候变化大会于2009年12月7-18日在哥本哈根召开.中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~45%.
(1)有效“减碳”的手段之一是节能.下列制氢方法最节能的是
A.电解水制氢:2H2O
2H2↑+O2↑
B.高温使水分解制氢:2H2O
2H2↑+O2↑
C.太阳光催化分解水制氢:2H2O
2H2↑+O2↑
D.天然气制氢:CH4+H2O CO+3H2
CO+3H2
(2)CO2可转化成有机物实现碳循环.在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0kJ/mol,并达平衡.
CH3OH(g)+H2O(g)△H=-49.0kJ/mol,并达平衡.
①能说明上述反应达到平衡状态的是
A.混合气体的压强不随时间的变化而变化
B.混合气体的密度不随时间的变化而变化
C.单位时间内每消耗3mol H2,同时生成1mol H2O
D.CO2的体积分数在混合气体中保持不变
②采取下列措施能使平衡时CO2转化率增大的是
A.升高温度 B.恒温恒容充入He(g)
C.将H2O(g)从体系中分离 D.恒温恒容再充入1mol CO2和3mol H2
(3)CO2加氢合成DME(二甲醚)是解决能源危机的研究方向之一.
2CO2(g)+6H2(g)→CH3OCH3(g)+3H2O△H>0.请在坐标图中画出上述反应在有催化剂与无催化剂两种情况下反应过程中体系能量变化示意图,并进行必要标注.
查看习题详情和答案>>
(1)有效“减碳”的手段之一是节能.下列制氢方法最节能的是
C
C
.(填字母序号)A.电解水制氢:2H2O
| ||
B.高温使水分解制氢:2H2O
| ||
C.太阳光催化分解水制氢:2H2O
| ||
| 太阳光 |
D.天然气制氢:CH4+H2O
 CO+3H2
CO+3H2(2)CO2可转化成有机物实现碳循环.在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)△H=-49.0kJ/mol,并达平衡.
CH3OH(g)+H2O(g)△H=-49.0kJ/mol,并达平衡.①能说明上述反应达到平衡状态的是
AD
AD
(选填编号).A.混合气体的压强不随时间的变化而变化
B.混合气体的密度不随时间的变化而变化
C.单位时间内每消耗3mol H2,同时生成1mol H2O
D.CO2的体积分数在混合气体中保持不变
②采取下列措施能使平衡时CO2转化率增大的是
CD
CD
(选填编号).A.升高温度 B.恒温恒容充入He(g)

C.将H2O(g)从体系中分离 D.恒温恒容再充入1mol CO2和3mol H2
(3)CO2加氢合成DME(二甲醚)是解决能源危机的研究方向之一.
2CO2(g)+6H2(g)→CH3OCH3(g)+3H2O△H>0.请在坐标图中画出上述反应在有催化剂与无催化剂两种情况下反应过程中体系能量变化示意图,并进行必要标注.
(1)在25℃下,向浓度均为0.1mol?L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成 沉淀(填化学式),生成该沉淀的离子方程式为 .(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20.)
(2)发射飞船时肼(N2H4)与NO2作推力能源,两者反应产生氮气和水蒸气.已知:
①N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ/mol
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534kJ/mol
则肼与二氧化氮反应的热化学方程式为:
(3)飞船使用的氢氧燃料电池具有高能、轻便和不污染环境等优点.氢氧燃料电池有酸式和碱式两种,其电池总反应均为:2H2+O2=2H2O.酸式氢氧燃料电池的电解质溶液是强酸溶液,负极电极反应式可表示为:2H2-4e一=4H+,则其正极反应式为 ;碱式氢氧燃料电池中的电解质溶液是强碱溶液,其正极电极反应式可表示为:O2+2H2O+4e-=4OH-,则其负极反应式为 .
查看习题详情和答案>>
(2)发射飞船时肼(N2H4)与NO2作推力能源,两者反应产生氮气和水蒸气.已知:
①N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ/mol
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534kJ/mol
则肼与二氧化氮反应的热化学方程式为:
(3)飞船使用的氢氧燃料电池具有高能、轻便和不污染环境等优点.氢氧燃料电池有酸式和碱式两种,其电池总反应均为:2H2+O2=2H2O.酸式氢氧燃料电池的电解质溶液是强酸溶液,负极电极反应式可表示为:2H2-4e一=4H+,则其正极反应式为
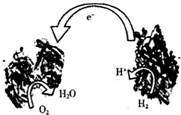 2006年,科学家发明了一种能够给电子设备提供动力的生物燃料电池.该电池的两个涂覆着催化剂酶的电极处于充满空气和少量氢气的玻璃槽中,总反应为:2H2+O2?2H2O,由于气体可以混合从而省去了昂贵的燃料隔离膜,其工作原理如图.下列说法不正确的是( )
2006年,科学家发明了一种能够给电子设备提供动力的生物燃料电池.该电池的两个涂覆着催化剂酶的电极处于充满空气和少量氢气的玻璃槽中,总反应为:2H2+O2?2H2O,由于气体可以混合从而省去了昂贵的燃料隔离膜,其工作原理如图.下列说法不正确的是( )| A、右边电极为该电池的负极 | B、该电池可以在高温环境下使用 | C、该装置为化学能转变为电能的装置 | D、该电池正极发生的是还原反应 |
“氢能”将是未来最理想的新能源.
(1)实验测得,1g氢气燃烧生成液态水时放出142.9kJ热量,则氢气燃烧的热化学方程式为 .(填序号)
A.2H2(g)+O2(g)=2H2O(l);△H=-142.9kJ?mol-1
B.H2(g)+
O2(g)=H2O(l);△H=-285.8kJ?mol-1
C.2H2+O2=2H2O(l);△H=-571.6kJ?mol-1
D.H2(g)+
O2(g)=H2O(g);△H=-285.8kJ?mol-1
(2)某化学家根据“原子经济”的思想,设计了如下制备H2的反应步骤
①CaBr2+H2O
CaO+2HBr
②2HBr+Hg
HgBr2+H2
③HgBr2+
④2HgO
2Hg+O2↑
⑤2H2+O2
2H2O
请你根据“原子经济”的思想完成上述步骤③的化学方程式: .并根据“绿色化学”的思想评估该方法制H2的主要缺点: .
(3)利用核能把水分解制氢气,是目前正在研究的课题.如图1是其中的一种流程,其中用了过量的碘.
完成下列反应的化学方程式:反应① ;反应② .此法制取氢气的最大优点是 .
(4)目前有科学家在一定条件下利用水煤气(CO+H2)合成甲醇:
CO(g)+2H2(g)
CH3OH(g).甲醇的物质的量与反应温度的关系如图2所示:
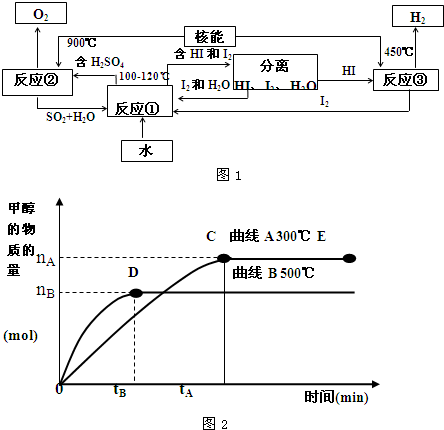
①合成甲醇反应,其反应热△H 0.(填“>”、“<”或“=”)
②其它条件不变,对处于E点的体系体积压缩到原来的
,正反应速率加快,逆反应速率 .(填“加快”、“减慢”、“不变”)重新平衡时
.(填“增大”、“减小”或“不变”)
③据研究,合成甲醇反应体系中通入少量CO2有利于维持催化剂Cu2O的量不变,原因是(用化学方程式表示) .
查看习题详情和答案>>
(1)实验测得,1g氢气燃烧生成液态水时放出142.9kJ热量,则氢气燃烧的热化学方程式为
A.2H2(g)+O2(g)=2H2O(l);△H=-142.9kJ?mol-1
B.H2(g)+
| 1 |
| 2 |
C.2H2+O2=2H2O(l);△H=-571.6kJ?mol-1
D.H2(g)+
| 1 |
| 2 |
(2)某化学家根据“原子经济”的思想,设计了如下制备H2的反应步骤
①CaBr2+H2O
| ||
②2HBr+Hg
| ||
③HgBr2+
| ||
④2HgO
| ||
⑤2H2+O2
| ||
请你根据“原子经济”的思想完成上述步骤③的化学方程式:
(3)利用核能把水分解制氢气,是目前正在研究的课题.如图1是其中的一种流程,其中用了过量的碘.
完成下列反应的化学方程式:反应①
(4)目前有科学家在一定条件下利用水煤气(CO+H2)合成甲醇:
CO(g)+2H2(g)
| CuO/ZnO |

①合成甲醇反应,其反应热△H
②其它条件不变,对处于E点的体系体积压缩到原来的
| 1 |
| 2 |
| c(CH3OH) |
| c(CO) |
③据研究,合成甲醇反应体系中通入少量CO2有利于维持催化剂Cu2O的量不变,原因是(用化学方程式表示)
(1)我国首创的海洋电池,总反应为:4Al+3O2+6H2O═4Al(OH)3,负极为
(2)航天技术使用氢氧电池具有高能、轻便,不污染优点,氢氧燃料电池有酸式和碱式两种,它们放电时的电池总反应式均可表示为:2H2+O2═2H2O.酸式氢氧燃料电池的电解质是酸,其负极反应为:2H2-4e-═4H+,则正极反应为
(3)蓄电池Pb+PbO2+2H2SO4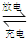 2PbSO4+2H2O放电时,正极电极反应式
2PbSO4+2H2O放电时,正极电极反应式
查看习题详情和答案>>
Al
Al
,负极发生氧化
氧化
反应(填“氧化”或“还原”),负极反应Al-3e-=Al3+
Al-3e-=Al3+
;正极为铂网,电流
电流
(填“电子”或“电流”)从铂极流出;海水为电解质溶液,海水中的Na+移向正极
正极
(填“正极”或“负极”).(2)航天技术使用氢氧电池具有高能、轻便,不污染优点,氢氧燃料电池有酸式和碱式两种,它们放电时的电池总反应式均可表示为:2H2+O2═2H2O.酸式氢氧燃料电池的电解质是酸,其负极反应为:2H2-4e-═4H+,则正极反应为
O2+4e-+4H+=2H2O
O2+4e-+4H+=2H2O
;碱式氢氧燃料电池的电解质是碱,其正极反应表示为:O2+2H2O+4e-═4OH-,则负极反应为:2H2-4e-+4OH-=4H2O
2H2-4e-+4OH-=4H2O
.(3)蓄电池Pb+PbO2+2H2SO4
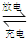 2PbSO4+2H2O放电时,正极电极反应式
2PbSO4+2H2O放电时,正极电极反应式PbO2+2e-+SO42-+4H+=PbSO4+2H2O
PbO2+2e-+SO42-+4H+=PbSO4+2H2O
,当电路中通过0.5mol电子时,消耗H2SO4的物质的量0.5mol
0.5mol
,负极增重24
24
g.