网址:http://m.1010jiajiao.com/timu3_id_215076[举报]
验证周期表中元素性质的变化规律:(1)同一周期内从左到右元素的金属性逐渐减弱;(2)同一主族内从上到下元素的非金属性逐渐减弱。从下表(Ⅰ)中选择实验方法,从(Ⅱ)中选择相应的实验现象,上下对应地填写在答案的空格中。(不一定全选)
| 实验方法(Ⅰ) | 实验现象(Ⅱ) |
| A.钠与冷水反应 | a.溶液变红色 |
| B.向NaOH溶液中滴加酚酞 | b.产生白烟 |
| C.点燃H2S | c.反应不十分剧烈,产生的气体能燃烧 |
| D.蘸浓氨水与浓盐酸的两玻璃棒接近 | d.浮于水面,熔成小球,迅速向四处游动 |
| E.NaI溶液中加入溴水 | e.生成白色胶状沉淀,后又溶解 |
| F.镁带与沸水反应 | f.产生大量气泡、气体可以点燃 |
| G.AlCl3溶液中加入NaOH溶液 | g.溶液变棕黄色 |
| H.NaCl溶液中加入溴水 | h.发出耀眼的强光,生成白色物质 |
| I.镁带空气中燃烧 | i.发出淡蓝色火焰 |
| J.NaBr溶液中加入氯水 | j.观察不出什么现象 |
| K.铝片与2mnol/L盐酸反应 | k.溶液变橙色 |
答案:
| (1)同周期 | (2)同主族 | |
| Ⅰ | ||
| Ⅱ |
解释在同一周期内从左到右金属性逐渐减弱的原因:
。
查看习题详情和答案>>实验是化学的最高法庭。以镁条、铝片为电极,以稀NaOH溶液为电解质溶液构成的原电池,人们普遍认为铝是负极。某研究性学习小组为探究该原电池究竟谁是负极,发生怎样的电极反应,进行了如下实验:
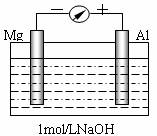
如图,剪取约8cm的镁条及大小相近的铝片,用砂纸去膜,使镁条与铝片分别与量程为500μA的教学演示电表的“-”、“+”端相连接,迅速将两电极插入盛有1mol/LNaOH溶液的烧杯中。开始,电表指针向右偏移约500μA,铝片表面有许多气泡,很快电流逐渐减小至0;随后,指针向左偏移,且电流逐渐增大至约400μA,此时,铝片表面气泡有所减少,但镁条表面只有极少量的气泡产生。根据以上实验现象,回答下列问题:
(1)开始阶段,原电池的正极是____(填“Mg”或“Al”)片;铝片表面产生的气泡是____;负极发生的反应是 。
(2)随后阶段,铝片发生的电极反应式是______________________________;镁条表面只有极少量的气泡产生,其原因是:2H2O+2e-=H2↑+2OH-(极少),试判断此电极发生的主要反应是_________________________;铝片表面气泡有所减少,但未消失,产生这一现象的可能原因是 。
查看习题详情和答案>>
| |||||||||||
| |||||||||||
| |||||||||||