题目内容
验证周期表中元素性质的变化规律:(1)同一周期内从左到右元素的金属性逐渐减弱;(2)同一主族内从上到下元素的非金属性逐渐减弱。从下表(Ⅰ)中选择实验方法,从(Ⅱ)中选择相应的实验现象,上下对应地填写在答案的空格中。(不一定全选)
| 实验方法(Ⅰ) | 实验现象(Ⅱ) |
| A.钠与冷水反应 | a.溶液变红色 |
| B.向NaOH溶液中滴加酚酞 | b.产生白烟 |
| C.点燃H2S | c.反应不十分剧烈,产生的气体能燃烧 |
| D.蘸浓氨水与浓盐酸的两玻璃棒接近 | d.浮于水面,熔成小球,迅速向四处游动 |
| E.NaI溶液中加入溴水 | e.生成白色胶状沉淀,后又溶解 |
| F.镁带与沸水反应 | f.产生大量气泡、气体可以点燃 |
| G.AlCl3溶液中加入NaOH溶液 | g.溶液变棕黄色 |
| H.NaCl溶液中加入溴水 | h.发出耀眼的强光,生成白色物质 |
| I.镁带空气中燃烧 | i.发出淡蓝色火焰 |
| J.NaBr溶液中加入氯水 | j.观察不出什么现象 |
| K.铝片与2mnol/L盐酸反应 | k.溶液变橙色 |
答案:
| (1)同周期 | (2)同主族 | |
| Ⅰ | ||
| Ⅱ |
解释在同一周期内从左到右金属性逐渐减弱的原因:
。
(1)同周期
(2)同主族
Ⅰ
A、F、H
E、H、J
Ⅱ
d、c、f
g、j、k
同一周期从左到右,随着原子序数的递增,原子核对外层电子的引力逐渐增强,失电子能力逐渐减弱,元素的金属性逐渐减弱。

 全能测控期末小状元系列答案
全能测控期末小状元系列答案1(5分) 验证周期表中元素性质的变化规律:(1)同一周期内从左到右元素的金属性逐渐减弱;(2)同一主族内从上到下元素的非金属性逐渐减弱。从下表(Ⅰ)中选择实验方法,从(Ⅱ)中选择相应的实验现象,上下对应地填写在答案的空格中。(不一定全选,也可重复选择)
实验方法(Ⅰ) | 实验现象(Ⅱ) |
A.钠与冷水反应 | a.溶液变红色 |
B.向NaOH溶液中滴加酚酞 | b.观察不到明显现象 |
C.镁带空气中燃烧 | c.反应不十分剧烈,有无色气泡产生 |
D.NaBr溶液中加入氯水 | d.浮于水面,熔成小球,迅速向四处游动 |
E.NaI溶液中加入溴水,加CCl4,振荡静置 | e.生成白色胶状沉淀,后又溶解 |
F.镁带与沸水反应 | f.溶液变橙色 |
G.AlCl3溶液中加入NaOH溶液 | g.溶液分为两层,下层显紫红色 |
H.铝片与沸水 | h.发出耀眼的强光,生成白色物质 |
| (1)同周期 | (2)同主族 |
Ⅰ |
|
|
Ⅱ |
|
|
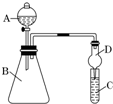 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
