摘要:12. 下列各组物质间.不能发生反应的是( ) A.S与NaOH溶液 B.SO2与H2O2溶液 C.SiO2与碳 D.SiO2与浓硝酸
网址:http://m.1010jiajiao.com/timu3_id_214883[举报]
Ⅰ、在一定温度下,氧化铁可以与一氧化碳发生反应:
Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g).已知该反应在不同温度下的平衡常数如下表:
请回答下列问题:
该反应的平衡常数表达式K=
Ⅱ、工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ/mol
某小组研究在相同温度下该反应过程中的能量变化.他们分别在体积均为V L的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应.相关数据如下:
(1)容器①中反应达平衡时,CO的转化率为
(2)计算容器②中反应的平衡常数K=
(3)下列叙述正确的是
a.平衡时,两容器中H2的体积分数相等
b.容器②中反应达平衡状态时,Q>65.6kJ
c.反应开始时,两容器中反应的化学反应速率相等
d.容器①中,化学反应速率为:v(H2O)=
mol/(L?min)
查看习题详情和答案>>
Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g).已知该反应在不同温度下的平衡常数如下表:
| 温度/℃ | 1 000 | 1 150 | 1 300 |
| 平衡常数 | 64.0 | 50.7 | 42.9 |
该反应的平衡常数表达式K=
K=
| c3(CO3) |
| c3(CO) |
K=
,△H| c3(CO3) |
| c3(CO) |
<
<
0(填“>”、“<”或“=”).Ⅱ、工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ/mol
某小组研究在相同温度下该反应过程中的能量变化.他们分别在体积均为V L的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应.相关数据如下:
| 容器编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达平衡时体系能量的变化/kJ | ||||
| CO | H2O | CO2 | H2 | ||||
| ① | 1 | 4 | 0 | 0 | t1 | 放出热量:32.8kJ | |
| ② | 2 | 8 | 0 | 0 | t2 | 放出热量:Q | |
80%
80%
.(2)计算容器②中反应的平衡常数K=
1
1
.(3)下列叙述正确的是
a
a
(填字母序号).a.平衡时,两容器中H2的体积分数相等
b.容器②中反应达平衡状态时,Q>65.6kJ
c.反应开始时,两容器中反应的化学反应速率相等
d.容器①中,化学反应速率为:v(H2O)=
| 4 |
| Vt1 |
煤经过化学加工可转化为气体或液体燃料以及各种化工产品,从而提高了煤的利用率.
(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)?CO(g)+H2(g)△H=131.5kJ?mol-1
①下列措施中,不能提高碳的转化率的是______(填字母序号).
a.容器的容积不变,增加水蒸汽的物质的量 b.缩小容器的容积,增大压强
c.及时将水煤气从容器中移走 d.其他条件不变,升高温度
②又知,C(s)+CO2(g)?2CO(g)△H=172.5kJ?mol-1.则CO(g)+H2O(g)?CO2(g)+H2(g)的焓变(△H)为______.
(2)CO与H2在一定条件下可反应生成甲醇,CO(g)+2H2?CH3OH(g).甲醇是一种燃料,可用于设计燃料电池.下图是甲醇燃料电池的原理示意图.
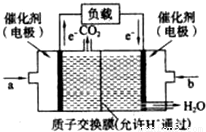
①a处通入的是______(填物质名称),左侧电极上发生______(填“氧化”或“还原”)反应.
②该电池工作过程中,H+的移动方向为从______到______(填“左”或“右”)
③该电池正极反应式为______.
④若用该电池提供的电能电解60mL NaCl溶液,设有0.01mol CH3OH完全放电,NaCl足量,且电解产生的Cl2全部溢出,电解前后忽略溶液体积的变化,则电解结束后所得溶液的pH=______.
(3)将等量的CO(g)和H2O(g)分别通入到容积为2L的恒容密闭容器中进行如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H=akJ?mol-1,得到下列数据:
①在实验1中,以v(CO2)表示该反应的反应速率为______mol?L-1?min-1;
②在实验2中,t______5.(填“>”、“<”或“=”)
查看习题详情和答案>>
(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)?CO(g)+H2(g)△H=131.5kJ?mol-1
①下列措施中,不能提高碳的转化率的是______(填字母序号).
a.容器的容积不变,增加水蒸汽的物质的量 b.缩小容器的容积,增大压强
c.及时将水煤气从容器中移走 d.其他条件不变,升高温度
②又知,C(s)+CO2(g)?2CO(g)△H=172.5kJ?mol-1.则CO(g)+H2O(g)?CO2(g)+H2(g)的焓变(△H)为______.
(2)CO与H2在一定条件下可反应生成甲醇,CO(g)+2H2?CH3OH(g).甲醇是一种燃料,可用于设计燃料电池.下图是甲醇燃料电池的原理示意图.

①a处通入的是______(填物质名称),左侧电极上发生______(填“氧化”或“还原”)反应.
②该电池工作过程中,H+的移动方向为从______到______(填“左”或“右”)
③该电池正极反应式为______.
④若用该电池提供的电能电解60mL NaCl溶液,设有0.01mol CH3OH完全放电,NaCl足量,且电解产生的Cl2全部溢出,电解前后忽略溶液体积的变化,则电解结束后所得溶液的pH=______.
(3)将等量的CO(g)和H2O(g)分别通入到容积为2L的恒容密闭容器中进行如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H=akJ?mol-1,得到下列数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | H2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 2 | 4 | 0.9 | t |
②在实验2中,t______5.(填“>”、“<”或“=”)
查看习题详情和答案>>