摘要:24.下表是元素周期表的一部分.根据表中8种元素.用元素符号或化学式填空 主族 周期 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0族 2 ① K^S* 3 ② ③ ④ ⑤ ⑥ ⑦ 4 ⑧ (1)④和⑧原子序数相差 . (2)在这些元素中最不活泼的元素为 .其原子结构示意图为 (3)最高价氧化物水化物碱性最强的是 .电子式: . 熔化时克服作用力为: . K^S* (4)最高价氧化物的水化物呈两性的是 . 最高价氧化物水化物酸性最强的是 .所属化合物类型为 化合物, (5)⑥所形成的单质与NaOH溶液反应的化学方程式为 . (6)⑤⑥⑧所形成的离子.半径由小到大的顺序是 , (7)②③两元素金属性较强的是 .可以验证该结论的实验是 . A.将在空气中放置已久的这两种元素的块状单质分别放入热水中 B.将除掉表面氧化膜的这两种元素的单质分别和同浓度的盐酸反应 C.将这两种元素的单质粉末分别和热水作用.并滴入酚酞溶液 D.比较这两种元素的气态氢化物的热稳定性
网址:http://m.1010jiajiao.com/timu3_id_214843[举报]
下表是元素周期表的一部分,根据下表用元素符号或化学式填空:
(1)这九种元素分别为A
F
(2)A、C、D三种元素的氧化物对应的水化物,其中碱性最强的是
(3)A、B、C三种元素按原子半径由大到小的顺序排列为
(4)写出F元素的氢化物在常温下跟B元素的单质发生反应的化学方程式并标出电子转移的方向和数目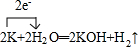
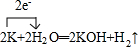 .
.
(5)H元素跟A元素形成化合物的电子式是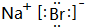
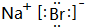 .高温灼烧该化合物时,火焰呈
.高温灼烧该化合物时,火焰呈
(6)H元素和G元素两者核电荷数之差是
查看习题详情和答案>>
| 主族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H |
Na
Na
、BK
K
、CMg
Mg
、DAl
Al
、EC
C
、F
O
O
、GCl
Cl
、HBr
Br
、RAr
Ar
,其中化学性质最不活泼的是Ar
Ar
.(2)A、C、D三种元素的氧化物对应的水化物,其中碱性最强的是
NaOH
NaOH
.(3)A、B、C三种元素按原子半径由大到小的顺序排列为
K+>Na+>Mg2+
K+>Na+>Mg2+
.(4)写出F元素的氢化物在常温下跟B元素的单质发生反应的化学方程式并标出电子转移的方向和数目
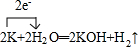
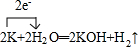
(5)H元素跟A元素形成化合物的电子式是
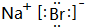
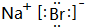
黄
黄
色.(6)H元素和G元素两者核电荷数之差是
18
18
.下表是元素周期表的一部分,根据表中10种元素,用元素符号或化学式填空.
(1)①~⑩元素中,金属性最强的是
(2)①~⑩元素中,最高价氧化物水化物呈两性的是
(3)①~⑩元素中,最高价氧化物水化物酸性最强的是
(4)⑤、⑥、⑧、⑨所形成的离子,其半径由小到大的顺序是
查看习题详情和答案>>
| 主族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||
| 4 | ⑨ | ⑧ | ⑩ |
K
K
;化学性质最不活泼的是Ar
Ar
.(2)①~⑩元素中,最高价氧化物水化物呈两性的是
Al
Al
,该化合物与NaOH溶液反应的离子方程式为Al(OH)3+NaOH═NaAlO2+2H2O
Al(OH)3+NaOH═NaAlO2+2H2O
;(3)①~⑩元素中,最高价氧化物水化物酸性最强的是
Cl
Cl
,碱性最强的是K
K
;(4)⑤、⑥、⑧、⑨所形成的离子,其半径由小到大的顺序是
S2->Cl->K+>Ca2+
S2->Cl->K+>Ca2+
.下表是元素周期表的一部分,根据所给的10种元素,回答下列问题.
(1)非金属性最强的元素是
(2)Ne原子结构示意图为
 ;
;
(3)C与N中,原子半径较小的是
(4)氯水具有漂白作用,是由于其中含有
(5)元素最高价氧化物对应的水化物中,碱性最强的是
(6)N元素的氢化物和它的最高价氧化物对应的水化物能反应生成一种盐,该盐的化学式为
(7)碳原子能与氢原子结合成6原子16电子的有机物,该有机物中碳元素与氢元素的质量比m(C):m(H)=
(8)镁是制造汽车、飞机、火箭的重要材料.写出工业上电解熔融氯化镁获得金属镁的化学方程式
查看习题详情和答案>>
| 周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | O |
| 2 | C | N | F | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
F
F
;(2)Ne原子结构示意图为


(3)C与N中,原子半径较小的是
N
N
;(4)氯水具有漂白作用,是由于其中含有
HClO
HClO
(填“HCl”或“HClO”)(5)元素最高价氧化物对应的水化物中,碱性最强的是
NaOH
NaOH
(填化学式),酸性最强的是HClO4
HClO4
(填化学式)呈两性的是Al(OH)3
Al(OH)3
(填化学式);(6)N元素的氢化物和它的最高价氧化物对应的水化物能反应生成一种盐,该盐的化学式为
NH4NO3
NH4NO3
(7)碳原子能与氢原子结合成6原子16电子的有机物,该有机物中碳元素与氢元素的质量比m(C):m(H)=
6:1
6:1
.请写出该有机物与溴水反应的化学方程式CH2=CH2+Br2→CH2BrCH2Br
CH2=CH2+Br2→CH2BrCH2Br
(8)镁是制造汽车、飞机、火箭的重要材料.写出工业上电解熔融氯化镁获得金属镁的化学方程式
MgCl2
Mg+Cl2↑
| ||
MgCl2
Mg+Cl2↑
.
| ||
下表是元素周期表的一部分,根据所给的10 种元素,回答下列间题.
(1)非金属性最强的元素是
(2)Ne 原子结构示意图为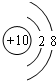
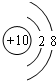 ;
;
(3)C 与N 中,原子半径较小的是
(4)氯水具有漂白作用,是由于其中含有
(5)元素最高价氧化物对应的水化物中,碱性最强的是
(6)元素硅的氧化物常用于制造
(7)如图为某有机物的球棍模型(其中 代表氢原子代表
代表氢原子代表  碳原子),
碳原子),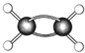 该有机物中碳元素与氢元素的质量比m(C):m(H)=
该有机物中碳元素与氢元素的质量比m(C):m(H)=
查看习题详情和答案>>
| 族 周期 |
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | C | N | F | Na | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
F
F
;(2)Ne 原子结构示意图为
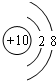
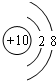
(3)C 与N 中,原子半径较小的是
N
N
;(4)氯水具有漂白作用,是由于其中含有
HClO
HClO
(填“HCl”或“HClO”)(5)元素最高价氧化物对应的水化物中,碱性最强的是
NaOH
NaOH
(填化学式),呈两性的是Al(OH)3
Al(OH)3
(填化学式);(6)元素硅的氧化物常用于制造
光导纤维
光导纤维
(填一种高性能的现代通讯材料的名称);(7)如图为某有机物的球棍模型(其中
 代表氢原子代表
代表氢原子代表  碳原子),
碳原子), 该有机物中碳元素与氢元素的质量比m(C):m(H)=
该有机物中碳元素与氢元素的质量比m(C):m(H)=6:1
6:1
.(相对原子质量C-12、H-l)(8)镁是制造汽车、飞机、火箭的重要材料.写出工业上电解熔融氯化镁获得金属镁的化学方程式MgCl2
Mg+Cl2↑
| ||
MgCl2
Mg+Cl2↑
.
| ||