摘要:25.CuCl2溶液400mL.经测定溶液中c(Cl-)=2mol/L,投入足量的锌粉ng..充分反应后.过滤.将所得滤渣洗涤.干燥后称量质重mg. (1)写出有关反应的离子方程式. (2)原溶液中c(Cu2+)是 . (3)反就前合金属粉末的质量差(n-m)为多少g. 忻州一中2009-2010学年第二学期期中考试 高一化学试卷
网址:http://m.1010jiajiao.com/timu3_id_214814[举报]
某学习小组拟通过实验探究某加碘食盐样品中碘元素的存在形式是IO3-而不是I-,并对该碘盐进行定量分析.
查阅资料知:
IO3-+5I-+6H+=3I2+3H2O
2IO3-+5HSO3-=I2+5SO42-+H2O+3H+
I2+2S2O32-=2I-+S4O62-
(1)设计实验方案,进行实验.在答卷上写出实验步骤、预期现象和结论.
限选试剂:稀硫酸、0.1mol/L AgNO3溶液、稀硝酸、1.0mol/L NaHSO3溶液、1.0mol/L KI溶液、新制氯水、1% 淀粉溶液、蒸馏水
(2)上述反应生成的I2可用四氯化碳检验.碘的四氯化碳溶液呈
(3)向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,可以回收四氯化碳.Na2SO3稀溶液与I2反应的离子方程式是
(4)该学习小组对该碘盐进行了定量分析:称取40.0g碘盐配成100mL溶液,取25.00mL该溶液于锥形瓶中,向锥形瓶中加入足量的碘化钾溶液,并加入1~2滴淀粉溶液,混合均匀后,逐滴加入物质的量浓度为0.001mol?L-1 Na2S2O3溶液15.00mL,恰好完全反应.
①滴定时Na2S2O3 溶液应放置于
②反应恰好完全依据的现象是
③该40.0g碘盐的含碘量为
查看习题详情和答案>>
查阅资料知:
IO3-+5I-+6H+=3I2+3H2O
2IO3-+5HSO3-=I2+5SO42-+H2O+3H+
I2+2S2O32-=2I-+S4O62-
(1)设计实验方案,进行实验.在答卷上写出实验步骤、预期现象和结论.
限选试剂:稀硫酸、0.1mol/L AgNO3溶液、稀硝酸、1.0mol/L NaHSO3溶液、1.0mol/L KI溶液、新制氯水、1% 淀粉溶液、蒸馏水
| 实验步骤 | 预期现象与结论 |
| 步骤1:取少量食盐样品于试管中,加适量蒸馏水使其完全溶解, 加入几滴新制的氯水,再加入1~2滴1%淀粉溶液 加入几滴新制的氯水,再加入1~2滴1%淀粉溶液 充分振荡. |
溶液不呈蓝色,则溶液中无I-,碘元素的存在形式不是I-. |
| 步骤2:另取少量食盐样品于试管中,加适量蒸馏水使其完全溶解, 加入几滴NaHSO3溶液,再加入1~2滴1%淀粉溶液 加入几滴NaHSO3溶液,再加入1~2滴1%淀粉溶液 充分振荡. |
溶液呈蓝色,则溶液中存在IO3-,碘元素的存在形式是IO3-. |
紫
紫
色.(3)向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,可以回收四氯化碳.Na2SO3稀溶液与I2反应的离子方程式是
I2+SO32-+H2O=2I-+SO42-+2H+
I2+SO32-+H2O=2I-+SO42-+2H+
.(4)该学习小组对该碘盐进行了定量分析:称取40.0g碘盐配成100mL溶液,取25.00mL该溶液于锥形瓶中,向锥形瓶中加入足量的碘化钾溶液,并加入1~2滴淀粉溶液,混合均匀后,逐滴加入物质的量浓度为0.001mol?L-1 Na2S2O3溶液15.00mL,恰好完全反应.
①滴定时Na2S2O3 溶液应放置于
碱式
碱式
滴定管中(填“酸式”或“碱式”).②反应恰好完全依据的现象是
溶液由蓝色恰好变为无色
溶液由蓝色恰好变为无色
.③该40.0g碘盐的含碘量为
1.0×10-5
1.0×10-5
mol.我国规定加碘食盐中碘的含量应在20~50mg/kg,该碘盐能
能
(填“能”或“不能”)达标.
硫代硫酸钠(Na2S2O3)俗称大苏打,照相业中用作定影剂.Na2S2O3易溶于水,在酸性溶液中与酸反应有单质硫和SO2生成.
(1)现有一瓶Na2S2O3固体,可能含有Na2SO4固体,请设计实验验证,写出实验步骤、预期现象和结论.限选试剂:1mol?L-1 H2SO4、1mol?L-1 HNO3、1mol?L-1 HCl、1mol?L-1 NaOH、0.1mol?L-1 Ba(NO3)2、
0.1mol?L-1 BaCl2、0.01mol?L-1 KMnO4、蒸馏水.
(2)已知重铬酸钠有较强的氧化性,一定条件下可将I-氧化为I2,自身还原为Cr3+,写出该反应的离子方程式: .
依此原理实验室可通过以下方法测定重铬酸钠(Na2Cr2O7?2H2O)样品的纯度:
称取重铬酸钠样品2.5g配成250mL溶液,取出25.00mL于锥形瓶中,加入10mL 2mol?L-1 H2SO4溶液和足量碘化钾,放于暗处5min,然后加入100mL水,再加入3mL淀粉指示剂,用0.1200mol?L-1 Na2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-).
①判断达到滴定终点的现象是 .
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品中的重铬酸纳的纯度为 (设Na2Cr2O7?2H2O的摩尔质量为298g?mol-1,整个过程中其它杂质不参与反应).
查看习题详情和答案>>
(1)现有一瓶Na2S2O3固体,可能含有Na2SO4固体,请设计实验验证,写出实验步骤、预期现象和结论.限选试剂:1mol?L-1 H2SO4、1mol?L-1 HNO3、1mol?L-1 HCl、1mol?L-1 NaOH、0.1mol?L-1 Ba(NO3)2、
0.1mol?L-1 BaCl2、0.01mol?L-1 KMnO4、蒸馏水.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量固体于试管A中,加蒸馏水溶解 | / |
| 步骤2:向试管A加入 | |
| 步骤3:取步骤2的少量上层清液于试管B中 |
依此原理实验室可通过以下方法测定重铬酸钠(Na2Cr2O7?2H2O)样品的纯度:
称取重铬酸钠样品2.5g配成250mL溶液,取出25.00mL于锥形瓶中,加入10mL 2mol?L-1 H2SO4溶液和足量碘化钾,放于暗处5min,然后加入100mL水,再加入3mL淀粉指示剂,用0.1200mol?L-1 Na2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-).
①判断达到滴定终点的现象是
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品中的重铬酸纳的纯度为
(2013?保定一模)重铬酸钾(K2Cr2O7)是工业生产和实验室的重要氧化剂.实验室模拟工业生产重铬酸钾时用铬铁矿(主要成份为FeO?Cr2O3)、纯碱、烧碱、氯酸钾等为原料先制得铬酸钠(Na2CrO4),涉及的主要反应是6FeO?Cr2O3+24NaOH+7KClO3
12Na2CrO4+3Fe2O3+7KCl+12H2O,然后将铬酸钠转化为K2Cr2O7.其主要工艺如下:
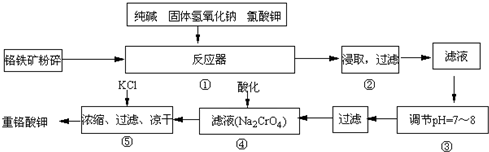
试回答下列问题:
(1)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐,写出氧化铝与碳酸钠反应的化学方程式:
(2)NaFeO2能强烈水解,在操作②生成沉淀而除去,写出该反应的化学方程式:
(3)操作③的目的是什么,用简要的文字和化学方程式说明:
(4)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式:
(5)称取重铬酸钾试样2.5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL 2mol/LH2SO4溶液和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定I2+2S2O32-=2I-+S4O62-.
①判断达到滴定终点的依据是:
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品中的重铬酸钾的纯度为:
查看习题详情和答案>>
| ||

试回答下列问题:
(1)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐,写出氧化铝与碳酸钠反应的化学方程式:
Al2O3+Na2CO3
2NaAlO2+CO2↑
| ||
Al2O3+Na2CO3
2NaAlO2+CO2↑
.
| ||
(2)NaFeO2能强烈水解,在操作②生成沉淀而除去,写出该反应的化学方程式:
NaFeO2+2H2O=Fe(OH)3↓+NaOH
NaFeO2+2H2O=Fe(OH)3↓+NaOH
.(3)操作③的目的是什么,用简要的文字和化学方程式说明:
由于硅酸钠和偏铝酸钠发生水解:SiO32-+2H2O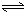 H2SiO3+2OH-(或SiO32-+H2O
H2SiO3+2OH-(或SiO32-+H2O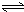 HSiO3-+OH-,HSiO3-+H2O
HSiO3-+OH-,HSiO3-+H2O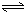 H2SiO3+OH-,AlO2-+H2O
H2SiO3+OH-,AlO2-+H2O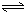 Al(OH)3+OH-),降低pH值有利于平衡向正反应方向移动,当pH调到7~8时,使它们水解完全
Al(OH)3+OH-),降低pH值有利于平衡向正反应方向移动,当pH调到7~8时,使它们水解完全
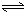 H2SiO3+2OH-(或SiO32-+H2O
H2SiO3+2OH-(或SiO32-+H2O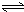 HSiO3-+OH-,HSiO3-+H2O
HSiO3-+OH-,HSiO3-+H2O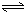 H2SiO3+OH-,AlO2-+H2O
H2SiO3+OH-,AlO2-+H2O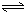 Al(OH)3+OH-),降低pH值有利于平衡向正反应方向移动,当pH调到7~8时,使它们水解完全
Al(OH)3+OH-),降低pH值有利于平衡向正反应方向移动,当pH调到7~8时,使它们水解完全由于硅酸钠和偏铝酸钠发生水解:SiO32-+2H2O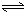 H2SiO3+2OH-(或SiO32-+H2O
H2SiO3+2OH-(或SiO32-+H2O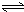 HSiO3-+OH-,HSiO3-+H2O
HSiO3-+OH-,HSiO3-+H2O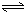 H2SiO3+OH-,AlO2-+H2O
H2SiO3+OH-,AlO2-+H2O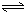 Al(OH)3+OH-),降低pH值有利于平衡向正反应方向移动,当pH调到7~8时,使它们水解完全
Al(OH)3+OH-),降低pH值有利于平衡向正反应方向移动,当pH调到7~8时,使它们水解完全
.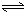 H2SiO3+2OH-(或SiO32-+H2O
H2SiO3+2OH-(或SiO32-+H2O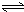 HSiO3-+OH-,HSiO3-+H2O
HSiO3-+OH-,HSiO3-+H2O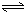 H2SiO3+OH-,AlO2-+H2O
H2SiO3+OH-,AlO2-+H2O Al(OH)3+OH-),降低pH值有利于平衡向正反应方向移动,当pH调到7~8时,使它们水解完全
Al(OH)3+OH-),降低pH值有利于平衡向正反应方向移动,当pH调到7~8时,使它们水解完全(4)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式:
2CrO42-+2H+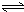 Cr2O72-+H2O
Cr2O72-+H2O
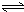 Cr2O72-+H2O
Cr2O72-+H2O2CrO42-+2H+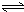 Cr2O72-+H2O
Cr2O72-+H2O
.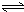 Cr2O72-+H2O
Cr2O72-+H2O(5)称取重铬酸钾试样2.5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL 2mol/LH2SO4溶液和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定I2+2S2O32-=2I-+S4O62-.
①判断达到滴定终点的依据是:
当滴加最后一滴硫代硫酸钠溶液时,溶液蓝色褪去,半分钟内不变色
当滴加最后一滴硫代硫酸钠溶液时,溶液蓝色褪去,半分钟内不变色
;②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品中的重铬酸钾的纯度为:
94.08%
94.08%
(设K2Cr2O7的摩尔质量为294g?mol-1,整个过程中其它杂质不参与反应).| 某实验小组以H2O2分解为例,研究浓度、催化剂、温度对反应速率的影响.按照如下方案完成实验.下列说法不正确的是 ( )
|
查看习题详情和答案>>
 硫酸渣是用黄铁矿制造硫酸过程中排出的废渣,主要化学成分为SiO2(约45%)、Fe2O3(约40%)、Al2O3(约10%)和MgO(约5%).某同学设计了如下方案,分离样品中各种金属元素.请回答下列问题.
硫酸渣是用黄铁矿制造硫酸过程中排出的废渣,主要化学成分为SiO2(约45%)、Fe2O3(约40%)、Al2O3(约10%)和MgO(约5%).某同学设计了如下方案,分离样品中各种金属元素.请回答下列问题.(1)写出溶液B的溶质是
(2)参照以下框图形式进一步完成“溶液C”到“Al2O3”的流程(注明试剂、条件和操作).

(3)为了分析某硫酸渣中铁元素的含量,先将硫酸渣预处理,把铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定.
①判断到达滴定终点的现象是
②某同学称取 2.000g硫酸渣,预处理后在容量瓶中配制成100mL溶液,移取25.00mL试样溶液,用0.0050mol?L-1KMnO4标准溶液滴定,达到滴定终点时,消耗标准溶液20.00mL,则残留物中铁元素的质量分数是