摘要:27A.B.C.D.E五种元素的原子序数依次增大.且均小于18,A原子的最外层比B原子的最外层少2个电子.A原子的最外层电子数是次外层电子数的两倍,A.B.C三种元素能结合成化合物C2AB3.在1 mol C2AB3中共有52mol电子.D元素的单质0.5mol与酸全部反应时.有9.03×1023个电子转移.在B与D形成的化合物.D的质量分数为52.94%.D原子核内有14个中子.每个E原子与氢原子化合时只生成了一个共价单键.试填写下列空白 (1)这五种元素的名称A B C D E (2)C在B中燃烧生成的化合物中化学键有 键和 键 (3)A.B.C结合成的化合物的化学式是 姓名: 班级: 考号: 学号(2位): 鹤岗一中2009~2010学年度下学期期中考试
网址:http://m.1010jiajiao.com/timu3_id_214512[举报]
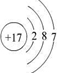
有A、B、C、D、E五种短周期元素,A元素的一种同位素原子核内不含中子,其单质为气体;B原子最外层电子数是次外层电子数的3倍,C 2+与B元素的离子具有相同的电子层结构;D与E原子具有相同的电子层数,且次外层电子数均为8;在同周期主族元素中原子半径E最大,D最小.回答下列问题:
(1)C 2+离子与D原子的结构示意图分别为: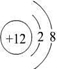
 、
、
 .
.
(2)B和E形成的两种化合物的电子式是:
 、
、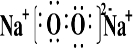
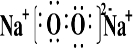
其中之一可与A 和B形成的化合物反应得到游离态B,写出该反应的化学方程式:
(3)由这五种元素中的几种形成的化合物中碱性最强的是
查看习题详情和答案>>
(1)C 2+离子与D原子的结构示意图分别为:




(2)B和E形成的两种化合物的电子式是:


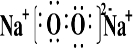
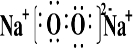
其中之一可与A 和B形成的化合物反应得到游离态B,写出该反应的化学方程式:
2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2H2O=4NaOH+O2↑
.(3)由这五种元素中的几种形成的化合物中碱性最强的是
NaOH
NaOH
(化学式),含氧酸酸性最强的是HClO4
HClO4
(化学式).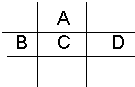 有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的单质可与酸反应,1mol E单质与足量酸作用,在标准状况下能产生33.6L H2;E的阳离子与A的阴离子核外电子层结构完全相同.
有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的单质可与酸反应,1mol E单质与足量酸作用,在标准状况下能产生33.6L H2;E的阳离子与A的阴离子核外电子层结构完全相同.请回答下列问题:
(1)这五种元素的名称分别为:A:
氧
氧
;C:硫
硫
; E:铝
铝
.(2)C的最高价氧化物化学式为
SO3
SO3
;D的单质与水反应的化学方程式为Cl2+H2O═HCl+HClO
Cl2+H2O═HCl+HClO
.(3)将适量D的新制水溶液滴加到装有一定量浓度的NaI溶液的试管中,再向试管中滴入2-3mL四氯化碳,振荡,静置后可观察到的现象是四氯化碳层显
紫或紫红
紫或紫红
色,有关反应的化学方程式为Cl2+2NaI═2NaCl+I2
Cl2+2NaI═2NaCl+I2
.下表是A、B、C、D、E五种有机物的有关信息;
根据表中信息回答下列问题:
(1)A与溴的四氯化碳溶液反应的生成物的名称叫做
(2)A与氢气发生加成反应后生成分子F,F在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2.当n=
(3)B具有的性质是
 .
.
(4)写出由C与D的反应生成相对分子质量为100的酯的化学反应方程式:
查看习题详情和答案>>
| A | B | C | D | E |
| ①能使溴的四氯化碳溶液褪色; ②比例模型为:  ③能与水在一定条件下反应生成C |
①由C、H两种元素组成; ②球棍模型为:  |
①由C、H、O三种元素组成; ②能与Na反应,但不能与NaOH溶液反应; ③能与E反应生成相对分子质量为100的酯. |
①相对分子质量比C少2; ②能由C氧化而成; |
①由C、H、O三种元素组成; ②球棍模型为:  |
(1)A与溴的四氯化碳溶液反应的生成物的名称叫做
1,2-二溴乙烷
1,2-二溴乙烷
;(2)A与氢气发生加成反应后生成分子F,F在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2.当n=
4
4
时,这类有机物开始出现同分异构体.(3)B具有的性质是
②③
②③
(填编号):①无色无味液体 ②有毒 ③不溶于水 ④密度比水大⑤与酸性KMnO4溶液和溴水反应褪色 ⑥任何条件下不与氢气反应;写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:

(4)写出由C与D的反应生成相对分子质量为100的酯的化学反应方程式:
CH2=CH-COOH+CH3CH2OH
CH2=CH-COOCH2CH3+H2O
| 浓硫酸 |
| △ |
CH2=CH-COOH+CH3CH2OH
CH2=CH-COOCH2CH3+H2O
.| 浓硫酸 |
| △ |
现有A、B、C、D、E五种元素,它们的质子数依次增多.
①A的核电荷数大于2,可形成氢化物H2A,该氢化物在常温下是液体;
②A和B两元素可形成B2A3化合物,该化合物既能溶于强酸,又能溶于强碱;
③C+离子比B3+离子多8个电子;
④C与D元素可以形成化合物CD;
⑤CD的溶液中通入氯气后加淀粉溶液显蓝色;
⑥在周期表中E处于C的下两个周期,E单质可与冷水反应生成氢气,反应时E的单质与生成的氢气的物质的量之比为2:1.试回答:
(1)B是
(2)B的离子结构示意图
 ,D的单质分子的电子式
,D的单质分子的电子式
 ,C元素最高价氧化物的水化物的电子式
,C元素最高价氧化物的水化物的电子式
 .
.
(3)用电子式表示H2A形成过程:

(4)写出CD的溶液中通入氯气的离子方程式:
(5)比较B、C、E三种元素形成的简单离子氧化性的强弱:(B、C、E离子用实际离子符号表示)氧化性:
查看习题详情和答案>>
①A的核电荷数大于2,可形成氢化物H2A,该氢化物在常温下是液体;
②A和B两元素可形成B2A3化合物,该化合物既能溶于强酸,又能溶于强碱;
③C+离子比B3+离子多8个电子;
④C与D元素可以形成化合物CD;
⑤CD的溶液中通入氯气后加淀粉溶液显蓝色;
⑥在周期表中E处于C的下两个周期,E单质可与冷水反应生成氢气,反应时E的单质与生成的氢气的物质的量之比为2:1.试回答:
(1)B是
铝
铝
、E是铯
铯
.(写元素名称):(2)B的离子结构示意图






(3)用电子式表示H2A形成过程:


(4)写出CD的溶液中通入氯气的离子方程式:
2I-+Cl2═I2+2Cl-
2I-+Cl2═I2+2Cl-
(5)比较B、C、E三种元素形成的简单离子氧化性的强弱:(B、C、E离子用实际离子符号表示)氧化性:
Al3+>K+>Cs+
Al3+>K+>Cs+
.