摘要:一定温度下.2molSO2和0.9molO2在容积固定的密闭容器中反应达到化学平衡状态.下列各项中该化学反应进行的限度最大的是( ) A.SO2的转化率为80% B.O2的转化率为85% C.平衡时SO2的物质的量为0.5mol D.平衡时SO3的物质的量为1.7mol
网址:http://m.1010jiajiao.com/timu3_id_214431[举报]
将0.3mol KMnO4在一定温度下加热后生成x molO2;将剩余固体与过量浓盐酸混合加热又生成y mol Cl2,此时锰元素全部以Mn2+形式存在.若x+y=a,则a的值可能为( )
| A、0.85 | B、0.75 | C、0.65 | D、0.60 |
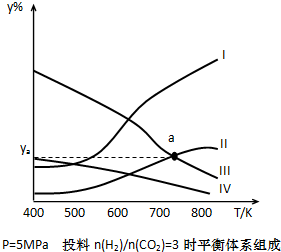 以CO2为碳源制取低碳有机物成为国际研究焦点,下面为CO2加氢制取乙醇的反应:2CO2(g)+6H2(g)
以CO2为碳源制取低碳有机物成为国际研究焦点,下面为CO2加氢制取乙醇的反应:2CO2(g)+6H2(g)| 催化剂 |
在密闭容器中,按H2与CO2的物质的量之比为3:1进行投料,在5MPa下测得不同温度下平衡体系中各种物质的体积分数(y%)如图所示.完成下列填空:
(1)表示CH3CH2OH体积分数曲线的是
(2)在一定温度下反应达到平衡的标志是
a.平衡常数K不再增大
b.CO2的转化率不再增大
c.混合气体的平均相对分子质量不再改变
d.反应物不再转化为生成物
(3)其他条件恒定,如果想提高CO2的反应速率,可以采取的反应条件是
a.降低温度 b.充入更多的H2 c.移去乙醇 d.增大容器体积
(4)图中曲线Ⅱ和Ⅲ的交点a对应的体积分数ya=
在一定温度下,1mol金属铜与足量某浓度的硝酸完全反应,生成NO2和NO的物质的量之比为1:3,则反应过程中转移的电子为( )
| A、2mol | B、3mol | C、4mol | D、5mol |
KClO3和浓HCl在一定温度下反应会生成黄绿色的易爆物二氧化氯.其反应可表述为:
KClO3+ HCl(浓)→ KCl+ ClO2+ Cl2+ H2O
(1)配平以上化学方程式(化学计量数填入划线上)并标出电子转移的方向和数目.
(2)反应中的氧化剂是 ,被氧化的元素是 ,ClO2是反应的 (填氧化或还原)产物.
(3)浓盐酸在反应中显示出来的性质是(填写号码)
①还原性 ②氧化性 ③酸性 ④碱性
(4)反应产生0.1mol Cl2,则转移的电子的物质的量为 mol
(5)ClO2具有很强的氧化性,因此可被用来做消毒剂,若ClO2作消毒剂后其自身转化为Cl-,则其消毒的效率(以单位质量得到电子数表示)是Cl2的 倍(保留2位小数).
查看习题详情和答案>>
(1)配平以上化学方程式(化学计量数填入划线上)并标出电子转移的方向和数目.
(2)反应中的氧化剂是
(3)浓盐酸在反应中显示出来的性质是(填写号码)
①还原性 ②氧化性 ③酸性 ④碱性
(4)反应产生0.1mol Cl2,则转移的电子的物质的量为
(5)ClO2具有很强的氧化性,因此可被用来做消毒剂,若ClO2作消毒剂后其自身转化为Cl-,则其消毒的效率(以单位质量得到电子数表示)是Cl2的
下列说法错误的是( )
| A、钢铁发生析氢腐蚀时,负极电极反应是Fe-2e-=Fe2+ | B、镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 | C、将pH=4的盐酸和醋酸稀释成pH=5的溶液,盐酸所需加入的水多 | D、一定温度下,反应MgCl2(l)=Mg(l)+Cl2(g)的△H>0△S>0 |