题目内容
 以CO2为碳源制取低碳有机物成为国际研究焦点,下面为CO2加氢制取乙醇的反应:2CO2(g)+6H2(g)
以CO2为碳源制取低碳有机物成为国际研究焦点,下面为CO2加氢制取乙醇的反应:2CO2(g)+6H2(g)| 催化剂 |
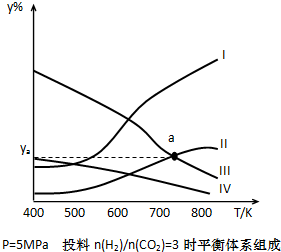
在密闭容器中,按H2与CO2的物质的量之比为3:1进行投料,在5MPa下测得不同温度下平衡体系中各种物质的体积分数(y%)如图所示.完成下列填空:
(1)表示CH3CH2OH体积分数曲线的是
(2)在一定温度下反应达到平衡的标志是
a.平衡常数K不再增大
b.CO2的转化率不再增大
c.混合气体的平均相对分子质量不再改变
d.反应物不再转化为生成物
(3)其他条件恒定,如果想提高CO2的反应速率,可以采取的反应条件是
a.降低温度 b.充入更多的H2 c.移去乙醇 d.增大容器体积
(4)图中曲线Ⅱ和Ⅲ的交点a对应的体积分数ya=
分析:(1)反应为吸热反应,升高温度平衡向正反应方向移动,升高温度CH3CH2OH含量升高,平衡时H2O的含量是CH3CH2OH含量的三倍;
(2)达到平衡有两个标志:一是正逆反应速率相等,二是各组分的浓度不再变化,以及由其延伸的量不再变化即是平衡状态;
(3)根据外界条件对反应速率的影响分析判断速率变化;提高物质转化率的方法是增加另一种物质,分离出生成物,改变温度、压强使平衡正向移动;
(4)a点为II和III的交点,设此时II C2H5OH体积为V,那么III H2也为V,根据方程式中的关系求出CO2和H2O的体积,再求体积分数ya.
(2)达到平衡有两个标志:一是正逆反应速率相等,二是各组分的浓度不再变化,以及由其延伸的量不再变化即是平衡状态;
(3)根据外界条件对反应速率的影响分析判断速率变化;提高物质转化率的方法是增加另一种物质,分离出生成物,改变温度、压强使平衡正向移动;
(4)a点为II和III的交点,设此时II C2H5OH体积为V,那么III H2也为V,根据方程式中的关系求出CO2和H2O的体积,再求体积分数ya.
解答:解:反应为吸热反应,升高温度平衡向正反应方向移动,升高温度CH3CH2OH含量升高,CO2与H2的含量降低,平衡时H2O的含量是CH3CH2OH含量的三倍,符合条件的曲线为II;
故答案为:II;
(2)在一定温度下反应达到平衡的标志是:
a.平衡常数K只与温度有关,与是否达到平衡状态无关,故a错误;
b.CO2的转化率不再增大,即反应达到限度,是平衡状态,故b正确;
c.反应后气体的物质的量减少,质量不变,所以混合气体的平均相对分子质量逐渐增大,当混合气体的平均相对分子质量不再改变时即是平衡状态,故c正确;
d.反应达到平衡状态是正逆反应仍在进行,所以不存在反应物不再转化为生成物的状态,故d错误;
故答案为:bc;
(3)其他条件恒定,如果想提高CO2的反应速率,可以采取的反应条件是:
a、降低温度,反应速率减小,故A错误;
b、补充H2,反应物的浓度增大,反应速率加快,故B正确;
c、移去甲醇,生成物浓度减小,速率降低,平衡向正反应移动,故c错误;
d、增大容器体积,各反应物的浓度减小,反应速率降低,故d错误;
故答案为:b;
达到平衡后,能提高H2转化率的操作是:
a、已知该反应为吸热反应,降低温度,平衡逆向移动,氢气的转化率减小,故a不符合;
b、补充H2,氢气反应物的浓度增大,提高二氧化碳转化率,本身转化率减小,故b不符合;
c、移去甲醇,生成物浓度减小,平衡向正反应移动,氢气转化率增大,故c符合;
d、增大容器体积,压强减小,平衡向逆方向移动,氢气的转化率减小,故d不符合;
故答案为:b;c;
(4)a点为II和III的交点,设此时II C2H5OH体积为V,那么III H2也为V,可知为CO2 为
V,H2O为C2H5OH的三倍,则为3V,
所以a对应的体积分数ya=
×100%=18.75%;
故答案为:18.75.
故答案为:II;
(2)在一定温度下反应达到平衡的标志是:
a.平衡常数K只与温度有关,与是否达到平衡状态无关,故a错误;
b.CO2的转化率不再增大,即反应达到限度,是平衡状态,故b正确;
c.反应后气体的物质的量减少,质量不变,所以混合气体的平均相对分子质量逐渐增大,当混合气体的平均相对分子质量不再改变时即是平衡状态,故c正确;
d.反应达到平衡状态是正逆反应仍在进行,所以不存在反应物不再转化为生成物的状态,故d错误;
故答案为:bc;
(3)其他条件恒定,如果想提高CO2的反应速率,可以采取的反应条件是:
a、降低温度,反应速率减小,故A错误;
b、补充H2,反应物的浓度增大,反应速率加快,故B正确;
c、移去甲醇,生成物浓度减小,速率降低,平衡向正反应移动,故c错误;
d、增大容器体积,各反应物的浓度减小,反应速率降低,故d错误;
故答案为:b;
达到平衡后,能提高H2转化率的操作是:
a、已知该反应为吸热反应,降低温度,平衡逆向移动,氢气的转化率减小,故a不符合;
b、补充H2,氢气反应物的浓度增大,提高二氧化碳转化率,本身转化率减小,故b不符合;
c、移去甲醇,生成物浓度减小,平衡向正反应移动,氢气转化率增大,故c符合;
d、增大容器体积,压强减小,平衡向逆方向移动,氢气的转化率减小,故d不符合;
故答案为:b;c;
(4)a点为II和III的交点,设此时II C2H5OH体积为V,那么III H2也为V,可知为CO2 为
| 1 |
| 3 |
所以a对应的体积分数ya=
| V | ||
V+V+
|
故答案为:18.75.
点评:本题考查化学平衡的平衡标志判断,转化率、反应速率的变化分析,化学反应速率的影响因素分析判断,平衡移动原理的应用,题目难度中等.

练习册系列答案
相关题目

 (2012?茂名二模)以CO2为碳源制取低碳有机物成为国际研究焦点,下面为CO2加氢制取低碳醇的热力学数据:
(2012?茂名二模)以CO2为碳源制取低碳有机物成为国际研究焦点,下面为CO2加氢制取低碳醇的热力学数据: CH3OH(g)+H2O(g) △H = —49.0 kJ·mol-1
CH3OH(g)+H2O(g) △H = —49.0 kJ·mol-1
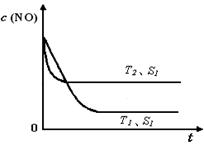
 2CO2(g)+ N2(g) 中NO的浓度随温度(T)、催化剂表面积(S)和时间(t)的变化曲线,若催化剂的表面积S1>S2 ,在上图中画出NO的浓度在T1、S2 条件下达到平衡过程中的变化曲线,并注明条件。
2CO2(g)+ N2(g) 中NO的浓度随温度(T)、催化剂表面积(S)和时间(t)的变化曲线,若催化剂的表面积S1>S2 ,在上图中画出NO的浓度在T1、S2 条件下达到平衡过程中的变化曲线,并注明条件。 CH3CH2OH(g)+3H2O(g) -Q(Q>0)
CH3CH2OH(g)+3H2O(g) -Q(Q>0)