摘要:28.(1) 2 H2O2 2H2O + O2↑ , (2)① 温度 . 浓度 ② 在其它条件相同时.过氧化氢的浓度越大.分解速率越大 ,(2分.其它合理答案也可以) (3) 催化剂接触表面积 .
网址:http://m.1010jiajiao.com/timu3_id_214173[举报]
通常状况下,过氧化氢是一种无色透明的液体,在实验室和生产中应用广泛.
(1)火箭推进器中分别装有联氨(N2H4)和过氧化氢,它们发生反应的热化学方程式为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) ΔH=-642.2 kJ·mol-1
又知:2H2O2(l)=2H2O(l)+O2(g) ΔH=-196.4 kJ·mol-1
H2O(l)=H2O(g) △H=44 kJ·mol-1
请写出N2H4(l)与O2(g)反应生成N2(g)和H2O(l)的热化学方程式:________.
(2)H2O2是一种二元弱酸,其第一步电离的电离方程式为________.
(3)过二硫酸铵法是目前最流行的制备H2O2的方法.即电解含H2SO4的(NH4)2SO4溶液制取(NH4)2S2O8,如下图所示,再加热水解即可得H2O2和(NH4)2SO4.

①电解时,阳极的电极方程式________;
②写出生成H2O2的反应的化学方程式:
________.
(4)Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能降解有机污染物p-CP.控制p-CP的初始浓度相同,在不同实验条件下进行如下实验,测得p-CP的浓度随时间变化关系如下图所示.
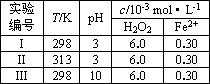
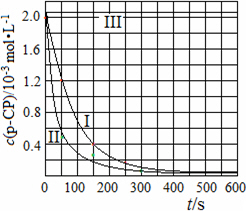
①请根据实验I的曲线,计算降解反应在50~150 s内的反应速率ν(p-CP)=________mol·L-1·s-1.
②实验I、II表明,温度升高,降解反应速率增大.但温度过高时反而导致降解反应速率减小,请分析原因:________.
③实验III得出的结论是:pH=10时,________.
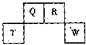 (2012?长宁区一模)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
(2012?长宁区一模)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:(1)T的离子结构示意图为


(2)元素的非金属性为(原子的得电子能力):Q
弱于
弱于
W(填“强于”或“弱于”).(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为
S+2H2SO4(浓)
3SO2+2H2O
| ||
S+2H2SO4(浓)
3SO2+2H2O
.
| ||
(4)原子序数比R多1的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是
2H2O2
O2↑+2H2O
| ||
2H2O2
O2↑+2H2O
.
| ||
(5)R有多种氧化物,其中甲的相对分子质量最小.在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是
NaNO2
NaNO2
I、磷、硫元素的单质和化合物应用广泛.
(1)磷元素的原子核外电子排布式是
1s22s22p63s23p3
1s22s22p63s23p3
.(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2→6CaSiO3+P4O10 10C+P4O10→P4+10CO
每生成1mol P4时,就有
20
20
mol电子发生转移.II、稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位.
(1)铈(Ce)是地壳中含量最高的稀土元素.在加热条件下CeCl3易发生水解,无水CeCl3可用加热CeCl3?6H2O和NH4Cl固体混合物的方法来制备.其中NH4Cl的作用是
分解出HCl气体,抑制CeCl3的水解
分解出HCl气体,抑制CeCl3的水解
.(2)在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,Ce3+通过下列反应形成Ce(OH)4沉淀得以分离.完成反应的离子方程式:
2
2
Ce3++1
1
H2O2+6
6
H2O→2
2
Ce(OH)4↓+6H+
6H+
在溶液中,反应A+2B?C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol/L、c(B)=0.200mol/L及c(C)=0mol/L.
反应物A的浓度随时间的变化如图所示.
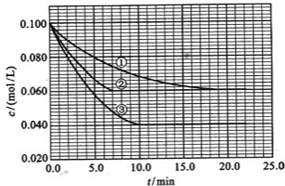
请回答下列问题:
(3)与①比较,②和③分别仅改变一种反应条件.所改变的条件和判断的理由是:②
加催化剂
加催化剂
;达到平衡的时间缩短,平衡时A的浓度未变
达到平衡的时间缩短,平衡时A的浓度未变
.③
温度升高
温度升高
;达到平衡的时间缩短,平衡时A的浓度减小
达到平衡的时间缩短,平衡时A的浓度减小
.(4)实验②平衡时B的转化率为
40%
40%
;实验③平衡时C的浓度为0.06mol/L
0.06mol/L
;(5)该反应是
吸热
吸热
热反应,判断其理由是温度升高,平衡向正反应方向移动
温度升高,平衡向正反应方向移动
;(6)该反应进行到4.0min时的平均反应速度率:
实验②:VB=
0.014mol(L?min)-1
0.014mol(L?min)-1
.通常状况下,过氧化氢是一种无色透明的液体,在实验室和生产中应用广泛.
(1)火箭推进器中分别装有联氨(N2H4)和过氧化氢,它们发生反应的热化学方程式为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-642.2kJ?mol-1
又知:2H2O2(l)=2H2O(l)+O2(g)△H=-196.4kJ?mol-1
H2O(l)=H2O(g)△H=44kJ?mol-1
请写出N2H4(l)与O2(g)反应生成N2(g)和H2O(l) 的热化学方程式: .
(2)H2O2是一种二元弱酸,其第一步电离的电离方程式为 .
(3)过二硫酸铵法是目前最流行的制备H2O2的方法.即电解含 H2SO4的(NH4)2SO4溶液制取(NH4)2S2O8,如图1所示,再加热水解即可得H2O2和(NH4)2SO4.
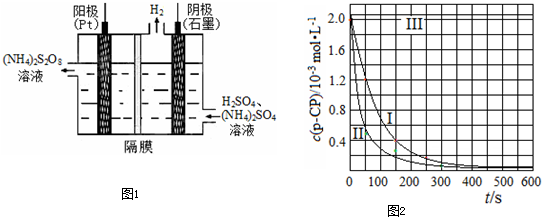
①电解时,阳极的电极方程式 ;
②写出生成H2O2的反应的化学方程式: .
(4)Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能降解有机污染物p-CP.控制p-CP的初始浓度相同,在不同实验条件下进行如下实验,测得p-CP的浓度随时间变化关系如图2所示.
①请根据实验I的曲线,计算降解反应
在50~150s内的反应速率ν(p-CP)= mol?L-1?s-1.
②实验Ⅰ、Ⅱ表明,温度升高,降解反应速率增大.但温度过高时反而导致降解反应速率减小,请分析原因: .
③实验Ⅲ得出的结论是:pH=10时, .
查看习题详情和答案>>
(1)火箭推进器中分别装有联氨(N2H4)和过氧化氢,它们发生反应的热化学方程式为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-642.2kJ?mol-1
又知:2H2O2(l)=2H2O(l)+O2(g)△H=-196.4kJ?mol-1
H2O(l)=H2O(g)△H=44kJ?mol-1
请写出N2H4(l)与O2(g)反应生成N2(g)和H2O(l) 的热化学方程式:
(2)H2O2是一种二元弱酸,其第一步电离的电离方程式为
(3)过二硫酸铵法是目前最流行的制备H2O2的方法.即电解含 H2SO4的(NH4)2SO4溶液制取(NH4)2S2O8,如图1所示,再加热水解即可得H2O2和(NH4)2SO4.

①电解时,阳极的电极方程式
②写出生成H2O2的反应的化学方程式:
(4)Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能降解有机污染物p-CP.控制p-CP的初始浓度相同,在不同实验条件下进行如下实验,测得p-CP的浓度随时间变化关系如图2所示.
| 实验 编号 |
T/K | pH | c/10-3mol?L-1 | |
| H2O2 | Fe2+ | |||
| Ⅰ | 298 | 3 | 6.0 | 0.30 |
| Ⅱ | 313 | 3 | 6.0 | 0.30 |
| Ⅲ | 298 | 10 | 6.0 | 0.30 |
在50~150s内的反应速率ν(p-CP)=
②实验Ⅰ、Ⅱ表明,温度升高,降解反应速率增大.但温度过高时反而导致降解反应速率减小,请分析原因:
③实验Ⅲ得出的结论是:pH=10时,