摘要:13.下列结论正确的是 ① 微粒半径:S2-> S>Cl-> F ② 氢化物的稳定性:HF>HCl>H2S>H2Te ③ 离子的还原性:S2->Cl->Br-> I- ④ 氧化性:Cl2>S>Se>Te ⑤ 酸性:H2SO4>HClO4>H2SeO4 ⑥ 非金属性:F>Cl>S>Se A.①②④⑥ B.①③④ C.①③ D.⑤⑥
网址:http://m.1010jiajiao.com/timu3_id_213548[举报]
T℃,向5.0L恒容密闭容器中充入1.0molSO3气体,发生反应:2SO3(g)?2SO2(g)+O2(g)△H=+196kJ/mol,一段时间后达到平衡,测得此过程中从外界共吸收了19.6kJ的热量.当温度度不变时,改变某一条件,下列结论正确的是( )
查看习题详情和答案>>
| 条件改变 | 结论 | |
| A | 平衡后向容器中充入1.0molHe | 平衡逆向移动,化学平衡常数减小 |
| B | 起始时向容器中充入1.0molSO2和0.50molO2 | 达到平衡时共放出78.4kJ的热量 |
| C | 起始时向容器中充入2.0molSO3、0.50mol SO2和0.25mol O2 | 反应达到平衡前v(正)>v(逆) |
| D | 起始时向容器中充入0.025molSO2和0.0125molO2 | 达到平衡时,SO2的转化率为50.0% |
(2013?浙江模拟)固体粉末X中可能含有Fe、FeO、CuO、MnO2、KCl和K2CO3中的若干种.
为确定该固体粉末的成分,某同学依次进行了以下实验:
①将X加入足量水中,得到不溶物Y和溶液Z;
②取少量Y加入足量浓盐酸,加热,产生黄绿色气体,并有少量红色不溶物;
③向Z溶液中滴加AgNO3溶液,生成白色沉淀;
④用玻璃棒蘸取溶液Z于广范pH试纸上,试纸呈蓝色.
分析以上实验现象,下列结论正确的是( )
为确定该固体粉末的成分,某同学依次进行了以下实验:
①将X加入足量水中,得到不溶物Y和溶液Z;
②取少量Y加入足量浓盐酸,加热,产生黄绿色气体,并有少量红色不溶物;
③向Z溶液中滴加AgNO3溶液,生成白色沉淀;
④用玻璃棒蘸取溶液Z于广范pH试纸上,试纸呈蓝色.
分析以上实验现象,下列结论正确的是( )
查看习题详情和答案>>
己知:2C(s)+O2(g)═2CO(g)△H=-221.0kJ?mol-1
2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ?mol-1
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ?mol-1
下列结论正确的是( )
2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ?mol-1
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ?mol-1
下列结论正确的是( )
| A、H2的燃烧热△H=-241.8kJ?mol-1 | B、炭和和水蒸气转化为水煤气为放热反应 | C、将24g 炭完全转化为水煤气,再充分燃烧,整个过程反应热为-787.0kJ?mol-1 | D、1mol H2O(g)完全分解需要吸收241.8kJ热量 |
T℃时,A气体与B气体反应生成C气体.反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是( )
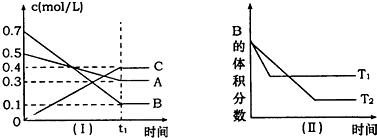

| A、在(t1+10)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动 | B、其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大 | C、T℃时,在相同容器中,若由0.4mol/L A、0.4mol/L B和0.2mol/L C反应,达到平衡后,C的浓度也为0.4 mol/L | D、(t1+10)min时,保持压强不变,通入稀有气体,平衡不移动 |