摘要:19 已知A.B.C.D.E五种物质有如图教育博客 所示的转化关系(部分反应物及反应条件未列出. 若解题时需要.可作合理假设).且五种物质中均 含有A元素. (1)若A为固体非金属单质 教育博客 ①D的化学式为 ②C→D的化学方程式 (2)若A为气态非金属单质教育博客 ① D物质的颜色是 ②A→B的化学方程式 ③E→C的离子方程式为 . 20A.B.C.D.E.F都是短周期主族元素.教育博客原子系数依次增大.其中B原子最外层上的电子数是其电子层数的2倍,教育博客A能和C形成原子个数比为1:1和2:1的物质,D也能和C形成原子个数比为1:1和2:1的物质,D.E.F元素的最高价氧化物的水化物两两皆能反应.都生成盐和水,F单质在常温下是一种气体.试回答:教育博客 (1)请写出下列元素的名称: C ,E , F ,教育博客 B在元素周期表中的位置是 . (2)B.C.F三种元素形成的氢化物中.沸点最高的是 . (3)A与C形成的含有18个电子的分子的电子式是 .教育博客 (4)C. D单质形成原子个数比为1:1的化合物的化学方程式是 . 教育博客 (5)E单质与D元素最高价氧化物的水化物反应的离子方程式是 .教育博客 21某溶液中可能含有Na+,K+,Br-,SO42-,CO32-等离子中的全部或其中的几种,现分别取三份溶液,进行如下操作: 教育博客 a.用洁净的铂丝蘸取溶液在无色火焰上灼烧,火焰呈黄色; 教育博客 b.溶液中通入氯气,溶液由无色变为橙色; 教育博客 c.溶液中加入过量的稀硫酸后,无气体放出,再加入教育博客Ba(NO3)2溶液后,产生白色沉淀. (1)原混合液中一定存在的离子是 , 教育博客一定不存在的离子是 . (2)为确定 离子是否存在,只需将c操作中如何改进? (3)为确定 离子是否存在,应补充的实验操作是 .
网址:http://m.1010jiajiao.com/timu3_id_213079[举报]
人民网西昌报道组10月1日电约19时26分,嫦娥二号宣布成功发射。据早些时候报道,昨天上午9时起,工作人员开始为“嫦娥二号”和长三丙火箭加注常规燃料,至14时30分左右加注的是燃烧剂;此后至18时左右加注氧化剂。


甲:嫦娥二号发射瞬间 乙:运行中的嫦娥二号
已知A、B、C、D是元素周期表中的四种短周期元素,且原子序数依次增大,A的单质是上述资料中的“燃烧剂”,C的单质是上述资料中的“氧化剂”;A元素原子中没有中子;bB与cC两种元素存在关系:b = c﹣1;C元素常见化合价的绝对值与其所在周期数相同,且B、C能形成多种气态化合物,其中一种可以在大自然状态下形成;A、D两种元素形成的双原子分子的水溶液是工业三大强酸之一。
请解答下列问题:
(1)A元素在元素周期表第 族中,D元素在元素周期表第 周期中。
(2)B原子的原子结构示意图: 。
(3)A、B两种元素形成的四原子分子的电子式为 。
(4)上图甲中发生反应的化学方程式为: 。
(5)A、B形成的六原子分子BA2—BA2也可以作为火箭发射中的燃烧剂,此时往往使用A、C形成的四原子分子(A2C2)作为氧化剂。已知8g BA2—BA2与足量A2C2反应,生成物均为无害气体,放出热量为160.35kJ。
请写出上述反应的热化学方程式: 。
查看习题详情和答案>>
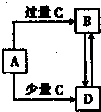 已知A、B、C、D均为中学化学中的常见物质,它们之间的转化关系如图所示(部分产物略去).则A、C可能的组合为①NaOH溶液、CO2 ②Ca(HCO3)2溶液、Ca(OH)2溶液③Fe、稀HNO3 ④Na、O2⑤CuO、C⑥A1Cl3溶液、NH3?H2O( )
已知A、B、C、D均为中学化学中的常见物质,它们之间的转化关系如图所示(部分产物略去).则A、C可能的组合为①NaOH溶液、CO2 ②Ca(HCO3)2溶液、Ca(OH)2溶液③Fe、稀HNO3 ④Na、O2⑤CuO、C⑥A1Cl3溶液、NH3?H2O( )| A、①②③④⑤ | B、①③④⑤⑥ | C、①②③⑤⑥ | D、只有①③⑤ |
(2011?沈阳二模)已知A、B、C、D四种分子所含原子的数目依次为1、3、6、2,且都含有18个电子,B、C是由两种元素的原子组成,且分子中两种原子的个数比均为1:2.D元素的氢化物能刻蚀玻璃.
(1)A的分子式是
(2)B分子的中心原子的杂化类型是
(3)C的化学式是
(4)D元素氢化物的沸点比HCl的沸点高,其主要原因是
查看习题详情和答案>>
(1)A的分子式是
Ar
Ar
,写出A原子的价层电子排布式3s23p6
3s23p6
.(2)B分子的中心原子的杂化类型是
sp3
sp3
,分子空间构型是V型
V型
,该分子属于极性
极性
分子(填“极性”或“非极性”).(3)C的化学式是
N2H4
N2H4
,分子中含有的化学键类型是非极性键、极性键
非极性键、极性键
.(4)D元素氢化物的沸点比HCl的沸点高,其主要原因是
HF分子之间能形成氢键
HF分子之间能形成氢键
.[化学一选修3:物质结构与性质]已知A、B、C、D、E都是元素周期表中前36号的元素,它们的原子序数依次增大.A原子基态时最外层电子数是其内层电子总数的2倍,8原子基态时s电子数与P电子数相等,C在元素周期表的各元素中电负性最大,D的基态原子核外有6个能级且全部充满电子,E原子基态时未成对电子数是同周期元素中最多的.
(1)基态E原子的价电子排布式为 .
(2)AB32-的立体构型是 ,其中A原子的杂化轨道类型是 .
(3)A22-与B22+互为等电子体,B22+的电子式可表示为 ,1mol B22+中含有的π键数目为 NA.
(4)用氢键表示式写出C的氢化物水溶液中存在的所有氢键 .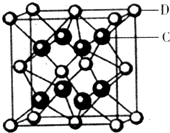
(5)化合物DC2的晶胞结构如图所示,该离子化合协晶体的密度为a g/cm3,则晶胞的体积是 cm3(只要求列算式,阿伏加德罗常数的值为NA).
查看习题详情和答案>>
(1)基态E原子的价电子排布式为
(2)AB32-的立体构型是
(3)A22-与B22+互为等电子体,B22+的电子式可表示为
(4)用氢键表示式写出C的氢化物水溶液中存在的所有氢键

(5)化合物DC2的晶胞结构如图所示,该离子化合协晶体的密度为a g/cm3,则晶胞的体积是
 已知A、B、C、D都是短周期元素,它们的原子半径大小为B>C>D>A.B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子有2个未成对电子.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体.E的硫酸盐溶液是制备波尔多液的原料之一.回答下列问题(用元素符号或化学式表示).
已知A、B、C、D都是短周期元素,它们的原子半径大小为B>C>D>A.B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子有2个未成对电子.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体.E的硫酸盐溶液是制备波尔多液的原料之一.回答下列问题(用元素符号或化学式表示).(1)M分子中B原子轨道的杂化类型为
sp2
sp2
,1mol M中含有σ键的数目为3NA(或3×6.02×1023)
3NA(或3×6.02×1023)
.(2)化合物CA3的沸点比化合物BA4的高,其主要原因是
NH3分子间能形成氢键
NH3分子间能形成氢键
.(3)写出与BD2互为等电子体的C3-的结构式
[N=N=N]-
[N=N=N]-
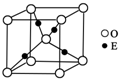
.(4)E+的核外电子排布式为,图是E的某种氧化物的晶胞结构示意图,氧的配位数为
4
4
.(5)向E的硫酸盐溶液中通入过量的CA3,写出该反应的离子方程式:
Cu2++4NH3=[Cu(NH3)4]2+
Cu2++4NH3=[Cu(NH3)4]2+
.