网址:http://m.1010jiajiao.com/timu3_id_213033[举报]
(12分)(1)有科学家提出“绿色自由”的构想:将CO2变为燃料或有机化学品。其构想分成3个步骤:
① 利用浓碳酸钾溶液吸收空气中的CO2;
② 将第①步吸收液电解产生H2和O2,同时分离出CO2;
③ 将第②步产生的H2和CO2在一定条件下转化成CH4和水蒸气。
已知:H2(g)+0.5O2(g)=H2O(l) △H1= —285.8 kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H2= —889.6 kJ/mol
H2O(l)=H2O(g) △H3= +44.0 kJ/mol
第③步反应的热化学方程式为 。
(2)使用合适的催化剂和电极材料,以N2、H2为原料,以HCl-NH4Cl为电解质溶液构成新型燃料电池,同时达到固氮作用。该电池的正极反应式为 ,溶液中H+向 极移动(选择填写“正”或“负”)。
(3)某催化剂的主要成分是FeO、Fe2O3,当催化剂中Fe2+与Fe3+的物质的量之比为1:2时,其催化活性最高。以Fe2O3为原料制备上述催化剂,可向其中加入适量炭粉,发生如下反应:
2Fe2O3+C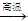 4FeO+CO2。为制得这种活性最高的催化剂,应向480 g Fe2O3粉末中加入炭粉的质量为_____g。
4FeO+CO2。为制得这种活性最高的催化剂,应向480 g Fe2O3粉末中加入炭粉的质量为_____g。
(4)在T℃时,向2L固定体积的密闭容器中加入4 mol A和2 mol B,发生如下反应:
2A(g) + B(g)  C(g) + D(g) △H = Q kJ·mol-1
C(g) + D(g) △H = Q kJ·mol-1
当反应达到平衡时,A的转化率为50﹪。
(ⅰ)在一定条件下,反应可以自发向右进行,可知Q __________0 (填“﹤”、“﹥”或“﹦”)。
(ⅱ)维持温度不变,若向该容器中加入的物质及量如下,使起始时v(正)>v(逆)且达到平衡时C的百分含量为20﹪。下列符合要求的是
A.2 mol A、1 mol B B.1 mol He、3 mol A、1.5 mol B、0.5molC、0.5mol D
C.2 mol C、2 mol D D.2 molA、1mol B、1 mol C、1 mol D
查看习题详情和答案>>
已知:N2(g)+3H2(g) 2NH3(g)△H=-92.4kJ/mol,这是目前普遍使用的人工固氮的方法。请回答下列问题:
2NH3(g)△H=-92.4kJ/mol,这是目前普遍使用的人工固氮的方法。请回答下列问题:
(1)450℃时,往一个2L的密闭容器中充入2. 6mol H2和1mol N2, 反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/mol·L—1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
②下列各项能作为判断该反应达到化学平衡状态的依据是__________(填序号字母)
A.容器内N2、H2、NH3的浓度之比为1:3:2
B.v(N2)正=3v(H2)逆 C.容器内压强保持不变
D.混合气体的密度保持不变 E.容器内混合气体的平均分子量不变
③若改变某一条件,达新平衡时n(H2)="1.60mol" ,下列说法正确的是_____________。
A.平衡一定正向移动 B.可能是向容器中加入了一定量的H2气体
C.可能是降低了容器的温度 D.可能是缩小了容器的体积
(2)450℃时,在另一密闭容器中进行上述合成氨的反应,各物质的起始浓度和平衡浓度如下表所示:
| | N2 | H2 | NH3 |
| 起始浓度(mol/L) | 0.2 | 0.3 | 0.2 |
| 平衡浓度(mol/L) | a | b | c |
①各物质的平衡浓度可能是_______________.
A.c="0.5mol/L " B.b="0.5mol/L " C.c="0.4mol/L " D.a=0.3mol/L
②a的取值范围是:_______________.
③请用数学表达式表示下列量之间的关系:
(I)a与b的关系:_______________。
(Ⅱ)a、b、c的关系:_______________。
(3) 根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水可发生下列反应:2N2(g)+6H2O(l)
 4NH3(g)+3O2(g),此反应的△S__________0(填“
4NH3(g)+3O2(g),此反应的△S__________0(填“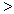 ”、 “
”、 “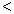 ”或“=”), △H=_____________。
”或“=”), △H=_____________。(已知:H2的燃烧热为285.8 kJ/mol) 查看习题详情和答案>>
 2NH3(g)△H=-92.4kJ/mol,这是目前普遍使用的人工固氮的方法。请回答下列问题:
2NH3(g)△H=-92.4kJ/mol,这是目前普遍使用的人工固氮的方法。请回答下列问题:(1)450℃时,往一个2L的密闭容器中充入2. 6mol H2和1mol N2, 反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/mol·L—1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
②下列各项能作为判断该反应达到化学平衡状态的依据是__________(填序号字母)
A.容器内N2、H2、NH3的浓度之比为1:3:2
B.v(N2)正=3v(H2)逆 C.容器内压强保持不变
D.混合气体的密度保持不变 E.容器内混合气体的平均分子量不变
③若改变某一条件,达新平衡时n(H2)="1.60mol" ,下列说法正确的是_____________。
A.平衡一定正向移动 B.可能是向容器中加入了一定量的H2气体
C.可能是降低了容器的温度 D.可能是缩小了容器的体积
(2)450℃时,在另一密闭容器中进行上述合成氨的反应,各物质的起始浓度和平衡浓度如下表所示:
| | N2 | H2 | NH3 |
| 起始浓度(mol/L) | 0.2 | 0.3 | 0.2 |
| 平衡浓度(mol/L) | a | b | c |
①各物质的平衡浓度可能是_______________.
A.c="0.5mol/L " B.b="0.5mol/L " C.c="0.4mol/L " D.a=0.3mol/L
②a的取值范围是:_______________.
③请用数学表达式表示下列量之间的关系:
(I)a与b的关系:_______________。
(Ⅱ)a、b、c的关系:_______________。
(3) 根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水可发生下列反应:2N2(g)+6H2O(l)
 4NH3(g)+3O2(g),此反应的△S__________0(填“
4NH3(g)+3O2(g),此反应的△S__________0(填“ ”、 “
”、 “ ”或“=”), △H=_____________。
”或“=”), △H=_____________。(已知:H2的燃烧热为285.8 kJ/mol)
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。回答下列关于氮元素的有关问题。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g) =4NO(g) + CO2(g) +2H2O(g) ;⊿H=" -574" kJ·mol-1
②CH4(g) +4NO(g) =2N2(g) + CO2(g) + 2H2O(g);⊿H=" -1160" kJ·mol-1
③H2O(g) = H2O(l) ; △H= -44.0 kJ·mol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(1)的热化学方程式 ,该反应的熵变⊿S 0(填“>”、“<”、“="”" )。
(2)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g) N2(g)+CO2(g) 。某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如右表:
N2(g)+CO2(g) 。某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如右表:
①10min~20min以V(CO2) 表示的反应速率为 。
②该反应的平衡常数的表达式为:K= ,根据表中数据,计算T1℃时该反应的平衡常数为 (保留两位小数)。
③下列各项能作为判断该反应达到平衡的是 (填序号字母)。
a.容器内压强保持不变 b.2V(NO)(正)= V(N2)(逆)
c.容器内CO2的体积分数不变 d.混合气体的密度保持不变
④30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是 。
⑤一定温度下,随着NO的起始浓度增大,则NO的平衡转化率 (填“增大”、“不变”或“减小”) 。
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。回答下列关于氮元素的有关问题。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g) =4NO(g) + CO2(g) +2H2O(g) ;⊿H=" -574" kJ·mol-1
②CH4(g) +4NO(g) =2N2(g) + CO2(g) + 2H2O(g);⊿H=" -1160" kJ·mol-1
③H2O(g) = H2O(l) ; △H= -44.0 kJ·mol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(1)的热化学方程式 ,该反应的熵变⊿S 0(填“>”、“<”、“="”" )。
(2)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g) N2(g)+CO2(g) 。某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如右表:
N2(g)+CO2(g) 。某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如右表:
①10min~20min以V(CO2) 表示的反应速率为 。
②该反应的平衡常数的表达式为:K= ,根据表中数据,计算T1℃时该反应的平衡常数为 (保留两位小数)。
③下列各项能作为判断该反应达到平衡的是 (填序号字母)。
a.容器内压强保持不变 b.2V(NO)(正)= V(N2)(逆)
c.容器内CO2的体积分数不变 d.混合气体的密度保持不变
④30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是 。
⑤一定温度下,随着NO的起始浓度增大,则NO的平衡转化率 (填“增大”、“不变”或“减小”) 。