摘要:某元素的原子2311 A .能与原子B形成A3B型化合物,则B的原子序数可能是( ) A· 7 B.8 C.9 D. 17
网址:http://m.1010jiajiao.com/timu3_id_212480[举报]
(2011?上海)根据元素周期表和元素周期律知识,完成下来填空:
(1)某元素的原子L层电子数比K层电子数多3个,该元素位于元素周期表中第
(2)硫元素的非金属性比氯元素的非金属性
(3)关于氟、钠、镁、氯四种元素的性质递变规律,描述正确的是
a.原子半径:Na<Cl b.离子半径:F-<Mg2+
c.热稳定性:HF>HCl d.碱性:NaOH>Mg(OH)2.
查看习题详情和答案>>
(1)某元素的原子L层电子数比K层电子数多3个,该元素位于元素周期表中第
二
二
周期,与该元素同一主族的短周期元素是P
P
.(2)硫元素的非金属性比氯元素的非金属性
弱
弱
(选填“强”、“弱”),能说明这一事实的化学方程式是Cl2+H2S=2HCl+S↓
Cl2+H2S=2HCl+S↓
(任写一个).(3)关于氟、钠、镁、氯四种元素的性质递变规律,描述正确的是
cd
cd
(填写编号).a.原子半径:Na<Cl b.离子半径:F-<Mg2+
c.热稳定性:HF>HCl d.碱性:NaOH>Mg(OH)2.
按要求回答下列问题
(1)某元素的原子的价电子构型为4s24p1,该元素的符号为
(2)某元素+3价离子的3d轨道半充满,该元素的符号为
(3)A元素的负二价离子和B元素的正二价离子的电子层结构都与氩相同,A的离子结构示意图为
 ,B的元素名称为
,B的元素名称为
(4)下列变化:H-(g)═H(g)+e-吸收的能力为73kJ/mol,H(g)═H+(g)+e-吸收的能力为1311kJ/mol,则氢负离子(H-)的第一电离能为
(5)N≡N的键能为942kJ/mol,N-N单键的键能为247kJ/mol,计算说明N2中的
查看习题详情和答案>>
(1)某元素的原子的价电子构型为4s24p1,该元素的符号为
Ga
Ga
.(2)某元素+3价离子的3d轨道半充满,该元素的符号为
Fe
Fe
.(3)A元素的负二价离子和B元素的正二价离子的电子层结构都与氩相同,A的离子结构示意图为


Ca
Ca
.(4)下列变化:H-(g)═H(g)+e-吸收的能力为73kJ/mol,H(g)═H+(g)+e-吸收的能力为1311kJ/mol,则氢负离子(H-)的第一电离能为
73kJ/mol
73kJ/mol
.(5)N≡N的键能为942kJ/mol,N-N单键的键能为247kJ/mol,计算说明N2中的
π
π
键更稳定(填“σ”或“π”).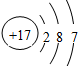 ,下列关于该原子的说法正确的是( )
,下列关于该原子的说法正确的是( )