摘要:0.75 mol RO32-共有30 mol电子.则R在周期表中的位置是 A.第二周期 B.第四周期 C.第ⅣA族 D.第ⅥA族
网址:http://m.1010jiajiao.com/timu3_id_212092[举报]
(2012?吉林一模)氨氧化法制硝酸的主要反应是:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)
(1)①该反应的熵变△S
②升高温度,反应的平衡常数K值减小,则该反应的焓变△H
(2)若其他条件不变,下列关系图错误的是
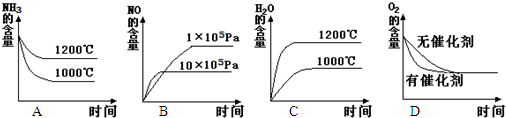
(3)在容积固定的密闭容器中发生上述反应,容器内各物质的浓度如下表:
①反应在第2min到第4min时,反应速率υ(O2)=
②反应在第2min时改变了条件,改变的条件可能是
查看习题详情和答案>>
(1)①该反应的熵变△S
>
>
0(填“>”、“<”或“=”).②升高温度,反应的平衡常数K值减小,则该反应的焓变△H
<
<
0(填“>”、“<”或“=”).(2)若其他条件不变,下列关系图错误的是
C
C
(选填序号).
(3)在容积固定的密闭容器中发生上述反应,容器内各物质的浓度如下表:
| 时间/浓度/(mol?L-1) | c(NH3) | c(O2) | c(NO) | c(H2O) |
| 起始 | 4.0 | 5.5 | 0 | 0 |
| 第 2min | 3.2 | 4.5 4.5 |
0.8 | 1.2 |
| 第 4min | 2.0 | 3.0 | 2.0 | 3.0 |
| 第 6min | 2.0 | 3.0 | 2.0 | 3.0 |
0.75 mol?L-1?min-1
0.75 mol?L-1?min-1
;②反应在第2min时改变了条件,改变的条件可能是
升高温度(或使用催化剂)
升高温度(或使用催化剂)
.该条件下,反应的平衡常数K=3
3
(只写计算结果,不标单位).用惰性电极电解2L 1?0mol?L-1 CuSO4溶液,在电路中通过0.5mol电子后,调换正负极继续电解,电路中通过了1mol电子,此时溶液中pH最接近的数值为(假设体积不变)( )
查看习题详情和答案>>
下列溶液经反应后,溶液内含有0.50mol NaHCO3和0.50mol Na2CO3的是( )
| A、0.50L 1.00 mol?L-1 NaHCO3加0.50L 0.50 mol?L-1 NaOH | B、0.50L 0.75 mol?L-1 Na2CO3加0.50L 0.50 mol?L-1 HCl | C、0.50L 1.00 mol?L-1 NaHCO3 加0.50L 0.25 mol?L-1 NaOH | D、1.00L 1.00 mol?L-1 Na2CO3 加1.00L 0.50 mol?L-1 HCl |