题目内容
(2012?吉林一模)氨氧化法制硝酸的主要反应是:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)
(1)①该反应的熵变△S
②升高温度,反应的平衡常数K值减小,则该反应的焓变△H
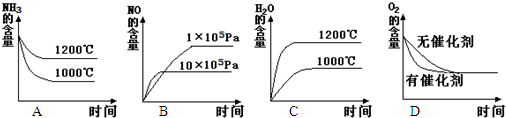
(2)若其他条件不变,下列关系图错误的是
(3)在容积固定的密闭容器中发生上述反应,容器内各物质的浓度如下表:
①反应在第2min到第4min时,反应速率υ(O2)=
②反应在第2min时改变了条件,改变的条件可能是
(1)①该反应的熵变△S
>
>
0(填“>”、“<”或“=”).②升高温度,反应的平衡常数K值减小,则该反应的焓变△H
<
<
0(填“>”、“<”或“=”).(2)若其他条件不变,下列关系图错误的是
C
C
(选填序号).
(3)在容积固定的密闭容器中发生上述反应,容器内各物质的浓度如下表:
| 时间/浓度/(mol?L-1) | c(NH3) | c(O2) | c(NO) | c(H2O) |
| 起始 | 4.0 | 5.5 | 0 | 0 |
| 第 2min | 3.2 | 4.5 4.5 |
0.8 | 1.2 |
| 第 4min | 2.0 | 3.0 | 2.0 | 3.0 |
| 第 6min | 2.0 | 3.0 | 2.0 | 3.0 |
0.75 mol?L-1?min-1
0.75 mol?L-1?min-1
;②反应在第2min时改变了条件,改变的条件可能是
升高温度(或使用催化剂)
升高温度(或使用催化剂)
.该条件下,反应的平衡常数K=3
3
(只写计算结果,不标单位).分析:(1)①根据反应中气体的物质的量的变化分析熵变;
②根据温度对K的影响,分析焓变;
(2)根据反应的特点分析温度、压强、催化剂对平衡的影响;
(3)①根据表中数据求出参加反应的量,再求速率;
②由表中数据可知第2min以后反应速率加快,据此分析.
②根据温度对K的影响,分析焓变;
(2)根据反应的特点分析温度、压强、催化剂对平衡的影响;
(3)①根据表中数据求出参加反应的量,再求速率;
②由表中数据可知第2min以后反应速率加快,据此分析.
解答:解:(1)①已知4NH3(g)+5O2(g)?4NO(g)+6H2O(g),反应后气体物质的量增大,所以熵增大,即△S>0,故答案为:>;
②升高温度,反应的平衡常数K值减小,说明平衡逆移,升高温度平衡逆移,则正反应为放热反应,即△H<0,故答案为:<;
(2)已知4NH3(g)+5O2(g)?4NO(g)+6H2O(g),△H<0,即该反应为体积增大的放热反应;
A、升高温度平衡逆移,所以温度越高NH3的含量越多,与图象相符,故正确;
B、增大压强平衡逆移,所以压强越大NO越小,与图象相符,故正确;
C、升高温度平衡逆移,所以温度越高H2O的含量越小,与图象不相符,故错误;
D、加催化剂不改变平衡,所以O2的含量不变,反应速率增大,到达平衡的时间变小,与图象相符,故正确;
故答案为:C;
(3)①第 2min 到第 4min 时△c(NH3)=3.2-2.0=1.2mol?L-1,所以△c(O2)=
×1.2mol?L-1=1.5mol?L-1,则v(O2)=
=0.75 mol?L-1?min-1,
故答案为:0.75 mol?L-1?min-1;
②由表中数据可知从0到2min时消耗了NH3为0.8 mol?L-1;第 2min 到第 4min 时消耗NH3为1.2mol?L-1,说明第 2min 以后反应速率加快,所以改变的条件为升高温度(或使用催化剂);
平衡时c(NH3)=2.0 mol?L-1,c(O2)=3.0mol?L-1,c(NO)=2.0mol?L-1,c(H2O)=3.0mol?L-1,则K=
=
=3,
故答案为:升高温度(或使用催化剂);3.
②升高温度,反应的平衡常数K值减小,说明平衡逆移,升高温度平衡逆移,则正反应为放热反应,即△H<0,故答案为:<;
(2)已知4NH3(g)+5O2(g)?4NO(g)+6H2O(g),△H<0,即该反应为体积增大的放热反应;
A、升高温度平衡逆移,所以温度越高NH3的含量越多,与图象相符,故正确;
B、增大压强平衡逆移,所以压强越大NO越小,与图象相符,故正确;
C、升高温度平衡逆移,所以温度越高H2O的含量越小,与图象不相符,故错误;
D、加催化剂不改变平衡,所以O2的含量不变,反应速率增大,到达平衡的时间变小,与图象相符,故正确;
故答案为:C;
(3)①第 2min 到第 4min 时△c(NH3)=3.2-2.0=1.2mol?L-1,所以△c(O2)=
| 5 |
| 4 |
| 1.5mol?L-1 |
| 2min |
故答案为:0.75 mol?L-1?min-1;
②由表中数据可知从0到2min时消耗了NH3为0.8 mol?L-1;第 2min 到第 4min 时消耗NH3为1.2mol?L-1,说明第 2min 以后反应速率加快,所以改变的条件为升高温度(或使用催化剂);
平衡时c(NH3)=2.0 mol?L-1,c(O2)=3.0mol?L-1,c(NO)=2.0mol?L-1,c(H2O)=3.0mol?L-1,则K=
| c6(H2O)?c4(NO) |
| c4(NH3)?c5(O2) |
| 36×24 |
| 35×24 |
故答案为:升高温度(或使用催化剂);3.
点评:本题考查了反应速率的计算、化学平衡的移动、平衡常数的计算等,综合性较强,难度较大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目