摘要:27.往10gNa2SiO3溶液中慢慢滴入一定浓度的稀盐酸.当反应完全时共用去稀盐酸20mL.将生成的沉淀滤去.在空气中灼烧后.称得残留固体质量为1.5g.求 (1)稀盐酸的物质的量浓度,(2)该Na2SiO3溶液的质量分数
网址:http://m.1010jiajiao.com/timu3_id_211797[举报]
某固体混合物可能由KCl、NaNO3、K2SO4、CuCl2、CaCl2、K2CO3中的一种或几种混合而成,为鉴定其组成,依次进行如下实验:
(1)混合物中加入足量水得一无色透明溶液,
(2)上述溶液中滴加 BaCl2有白色沉淀产生,
(3)过滤,然后向上述白色沉淀加盐酸时,沉淀全部溶解,
(4)往滤液中加AgNO3溶液时有白色沉淀产生且白色沉淀不溶于稀硝酸.
试判断:肯定存在的物质有
查看习题详情和答案>>
(1)混合物中加入足量水得一无色透明溶液,
(2)上述溶液中滴加 BaCl2有白色沉淀产生,
(3)过滤,然后向上述白色沉淀加盐酸时,沉淀全部溶解,
(4)往滤液中加AgNO3溶液时有白色沉淀产生且白色沉淀不溶于稀硝酸.
试判断:肯定存在的物质有
K2CO3
K2CO3
;肯定不存在的物质有K2SO4、CuCl2、CaCl2
K2SO4、CuCl2、CaCl2
;可能存在的物质有NaNO3、KCl
NaNO3、KCl
.据新闻报道有全国最“绿”省份之称的福建,近年来却频频受到酸雨的困扰.在饮用水源地水质状况方面,福建9个设区市的34个集中式生活饮用水源地水质达标率为73.3%,较上年同期有所下降.所以保护环境是我们刻不容缓的责任.
Ⅰ、烟气脱硫是控制二氧化硫污染的主要技术手段.
(1)利用海水脱硫是一种有效的方法,其工艺流程如图1所示:
某研究小组为探究提高含硫烟气中SO2的吸收效率的措施,进行了天然海水(pH≈8)吸收含硫烟气的模拟实验,实验结果如图2所示.
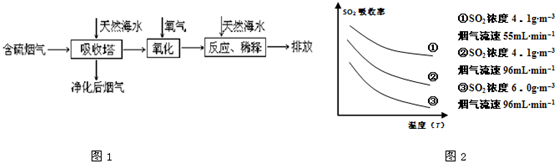
①根据图示实验结果,为了提高一定浓度含硫烟气中SO2的吸收效率,下列措施正确的是
A.降低通入含硫烟气的温度 B.减小通入含硫烟气的流速
C.减少天然海水的进入量 D.在天然海水中加入生石灰
②天然海水吸收了含硫烟气后会溶有H2SO3,使用空气中的氧气将其氧化,写出该反应的化学方程式:
(2)石灰石-石膏湿法烟气脱硫工艺技术的工作原理是烟气中的二氧化硫与浆液中的碳酸钙以及鼓入的空气反应生成石膏(CaSO4?2H2O).写出该反应的化学方程式:
Ⅱ.重金属离子对河流及海洋造成严重污染.某化工厂废水(pH≈2)中含有Ag+、Pb2+等重金属离子,其浓度各约为0.01mol?L-1.排放前拟用沉淀法除去这两种离子,查找有关数据如下:
(3)你认为往废水中投入
A.NaOH B.Na2S C.KI D.Ca(OH)2
(4)如果只用生石灰处理含有Pb2+的废水,使溶液的pH=8.0,处理后的废水中,c(Pb2+)=
查看习题详情和答案>>
Ⅰ、烟气脱硫是控制二氧化硫污染的主要技术手段.
(1)利用海水脱硫是一种有效的方法,其工艺流程如图1所示:
某研究小组为探究提高含硫烟气中SO2的吸收效率的措施,进行了天然海水(pH≈8)吸收含硫烟气的模拟实验,实验结果如图2所示.

①根据图示实验结果,为了提高一定浓度含硫烟气中SO2的吸收效率,下列措施正确的是
AB
AB
.(填字母序号)A.降低通入含硫烟气的温度 B.减小通入含硫烟气的流速
C.减少天然海水的进入量 D.在天然海水中加入生石灰
②天然海水吸收了含硫烟气后会溶有H2SO3,使用空气中的氧气将其氧化,写出该反应的化学方程式:
2H2SO3+O2=2H2SO4
2H2SO3+O2=2H2SO4
.氧化后的“海水”需要用大量的天然海水与之混合后才能排放,该操作的主要目的是中和、稀释经氧气氧化后海水中生成的酸(H+)
中和、稀释经氧气氧化后海水中生成的酸(H+)
.(2)石灰石-石膏湿法烟气脱硫工艺技术的工作原理是烟气中的二氧化硫与浆液中的碳酸钙以及鼓入的空气反应生成石膏(CaSO4?2H2O).写出该反应的化学方程式:
2CaCO3+2SO2+O2+4H2O═2CaSO4?2H2O+2CO2
2CaCO3+2SO2+O2+4H2O═2CaSO4?2H2O+2CO2
.Ⅱ.重金属离子对河流及海洋造成严重污染.某化工厂废水(pH≈2)中含有Ag+、Pb2+等重金属离子,其浓度各约为0.01mol?L-1.排放前拟用沉淀法除去这两种离子,查找有关数据如下:
| 难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| Ksp | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
B
B
(填字母序号),沉淀效果最好.A.NaOH B.Na2S C.KI D.Ca(OH)2
(4)如果只用生石灰处理含有Pb2+的废水,使溶液的pH=8.0,处理后的废水中,c(Pb2+)=
1.2×10-3mol?L-1
1.2×10-3mol?L-1
.若环境要求污水综合排放标准为c(Pb2+)低于1.0×l0-8mol?L-1,问处理后的废水是否符合排放标准?否
否
(填“是”或“否”).铁及其化合物在国民经济的发展中起着重要作用.
(1)已知:4Fe(s)+3O2(g)=2Fe2O3(s)△H=-1641.0kJ?mol-1
C(石墨)+1/2O2(g)=CO(g)△H=-110.5kJ?mol-1
则Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)的△H=
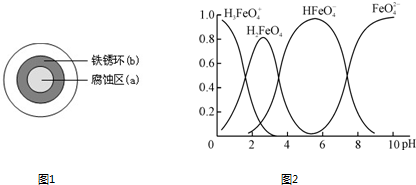
(2)铁在潮湿的空气中易发生电化学腐蚀.某同学将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图1所示.液滴边缘是
(3)铁钛合金是一种常用的不锈钢材料,某同学在探究该合金的性质时,往含有TiO2+、Fe3+溶液中加入铁屑至溶液显紫色,该过程中发生的反应有:
①2TiO2+(无色)+Fe+4H+=2Ti3+(紫色)+Fe2++2H2O
②Ti3+(紫色)+Fe3++H2O=TiO2+(无色)+Fe2++2H+
③
(4)①高铁酸钾(K2FeO4)是一种优良的水处理剂.
在水溶液中的存在形态如图2所示,纵坐标表示各存在形态的分数分布.
下列说法不正确的是
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=10的这种溶液中加硫酸至pH=2,HFe
的分布分数逐渐增大
C.向pH=6的这种溶液中加KOH溶液,发生反应的离子方程式为:HFe
+OH-═Fe
+H2O
②K2FeO4溶于水会放出一种无色无味气体,其杀菌消毒、吸附水中的悬浮杂质的原理可用离子方程式表示为
(5)向一定量的Fe、FeO、Fe3O4的混合物中加入100mL 1mol?L-1的盐酸,恰好使混合物完全溶解,放出224mL(标准状况)气体,加入KSCN溶液不显红色.若用足量的CO在高温下还原相同质量的此混合物,可得铁
查看习题详情和答案>>

(1)已知:4Fe(s)+3O2(g)=2Fe2O3(s)△H=-1641.0kJ?mol-1
C(石墨)+1/2O2(g)=CO(g)△H=-110.5kJ?mol-1
则Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)的△H=
+489.0kJ/mol
+489.0kJ/mol
kJ?mol-1.(2)铁在潮湿的空气中易发生电化学腐蚀.某同学将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图1所示.液滴边缘是
正极
正极
区(填“正极”或“负极”),其电极反应式为O2+2H2O+4e-=4OH-
O2+2H2O+4e-=4OH-
.(3)铁钛合金是一种常用的不锈钢材料,某同学在探究该合金的性质时,往含有TiO2+、Fe3+溶液中加入铁屑至溶液显紫色,该过程中发生的反应有:
①2TiO2+(无色)+Fe+4H+=2Ti3+(紫色)+Fe2++2H2O
②Ti3+(紫色)+Fe3++H2O=TiO2+(无色)+Fe2++2H+
③
2Fe3++Fe=3Fe2+
2Fe3++Fe=3Fe2+
.(4)①高铁酸钾(K2FeO4)是一种优良的水处理剂.
| FeO | 2- 4 |
下列说法不正确的是
AB
AB
.(填字母)A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=10的这种溶液中加硫酸至pH=2,HFe
| O | - 4 |
C.向pH=6的这种溶液中加KOH溶液,发生反应的离子方程式为:HFe
| O | - 4 |
| O | 2- 4 |
②K2FeO4溶于水会放出一种无色无味气体,其杀菌消毒、吸附水中的悬浮杂质的原理可用离子方程式表示为
4FeO42-+10H2O=4Fe(OH)3+8OH-+3O2↑
4FeO42-+10H2O=4Fe(OH)3+8OH-+3O2↑
.(5)向一定量的Fe、FeO、Fe3O4的混合物中加入100mL 1mol?L-1的盐酸,恰好使混合物完全溶解,放出224mL(标准状况)气体,加入KSCN溶液不显红色.若用足量的CO在高温下还原相同质量的此混合物,可得铁
2.8
2.8
g.有一固体混合物,可能由Na2CO3、Na2SO4、CuSO4、CaCl2、NaCl等混合组成,为了检验它们所含的物质,做了以下实验:①将固体溶于水,搅拌后得到无色透明溶液;②往此溶液中滴加硝酸钡溶液,有白色沉淀生成;③过滤,将沉淀置于稀硝酸中,发现沉淀部分溶解.试判断:
(1)固体混合物中肯定含有
(2)肯定没有
(3)可能含有
查看习题详情和答案>>
(1)固体混合物中肯定含有
Na2CO3、Na2SO4
Na2CO3、Na2SO4
,(2)肯定没有
CuSO4、CaCl2
CuSO4、CaCl2
,(3)可能含有
NaCl
NaCl
.向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续加氨水,难溶物溶解,得到深蓝色的透明溶液;若加入极性较小的溶剂(如乙醇),将析出深蓝色的晶体.
Ⅰ.在化学实验和科学研究中,水是一种最常用的溶剂.水是生命之源,它与我们的生活密切相关.
(1)写出与H2O分子互为等电子体的微粒
(2)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+).下列对上述过程的描述不合理的是
A.氧原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角发生了改变
(3)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序).与冰的晶体类型相同的是

Ⅱ.胆矾晶体是配制波尔多液的主要原料,波尔多液是一种保护性杀菌剂,广泛应用于树木、果树和花卉上.
(4)写出铜原子价电子层的电子排布式
(5)胆矾溶液与足量氨水形成的深蓝色溶液中的阳离子内存在的全部化学键类型有
(6)往(5)的深蓝色溶液中加入C2H5OH后可观察到析出深蓝色Cu(NH3)4SO4?H2O晶体.实验中所加C2H5OH的作用是
查看习题详情和答案>>
Ⅰ.在化学实验和科学研究中,水是一种最常用的溶剂.水是生命之源,它与我们的生活密切相关.
(1)写出与H2O分子互为等电子体的微粒
H2S、NH2-
H2S、NH2-
(填2种).(2)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+).下列对上述过程的描述不合理的是
A
A
.A.氧原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角发生了改变
(3)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序).与冰的晶体类型相同的是
BC
BC
(请用相应的编号填写).
Ⅱ.胆矾晶体是配制波尔多液的主要原料,波尔多液是一种保护性杀菌剂,广泛应用于树木、果树和花卉上.
(4)写出铜原子价电子层的电子排布式
3d104s1
3d104s1
,与铜同一周期的副族元素的基态原子中最外层电子数与铜原子相同的元素有Cr
Cr
(填元素符号).(5)胆矾溶液与足量氨水形成的深蓝色溶液中的阳离子内存在的全部化学键类型有
共价键、配位键
共价键、配位键
.(6)往(5)的深蓝色溶液中加入C2H5OH后可观察到析出深蓝色Cu(NH3)4SO4?H2O晶体.实验中所加C2H5OH的作用是
降低Cu(NH3)4SO4?H2O的溶解度
降低Cu(NH3)4SO4?H2O的溶解度
.