网址:http://m.1010jiajiao.com/timu3_id_210212[举报]
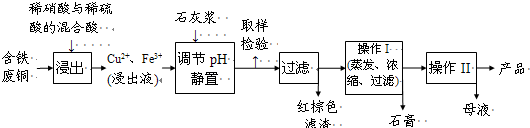
胆矾和石膏在不同温度下的溶解度(g/100g水)见下表.
| 温度(℃) | 20 | 40 | 60 | 80 | 100 |
| 石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
| 胆矾 | 32 | 44.6 | 61.8 | 83.8 | 114 |
(1)红棕色滤渣的主要成分是
(2)写出浸出过程中生成硫酸铜的化学方程式
(3)操作I的操作温度应该控制在
(4)从溶液中分离出硫酸铜晶体的操作II应为
(5)取样检验是为了确认Fe3+是否除净.有同学设计了以下两种方案,在实验室分别对所取样品按下列方案进行操作:
方案一:取样于试管→滴加KSCN溶液;
方案二:径向层析→喷KSCN溶液
①你认为上述两种方案设计更合理的是
②指出你认为不合理的方案存在的问题
(6)反应产物中的NO可以循环使用,用化学方程式表示循环使用的方案
II.(12分)复印机使用的墨粉主要成份是Fe3O4,图是氧化沉淀法生产Fe3O4的工艺:
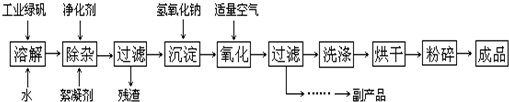
已知:
①工业绿矾中FeSO4的含量为52.5%,其中的杂质不参与反应;
②Fe(OH)2+2Fe(OH)3═Fe3O4?4H2O
请回答下列问题:
(1)铁的常见氧化物有
(2)Fe3O4与盐酸反应的化学方程式是:
(3)在工艺流程中,通入适量空气“氧化”时的化学方程式是:
(4)生产中可获得的副产品是
a.过滤 b.加热浓缩 c.冷却 d.结晶 e.洗涤
(5)在生产过程中,若工业绿矾的投料速率是12.16kg/h,为使产品较纯,鼓入空气的速率应为
工业上用电解法制烧碱的主要原料是饱和食盐水,它是将粗盐溶于水制成的.由于粗盐水中含有泥沙、CaCl2、MgCl2、Fe2(SO4)3等杂质,不符合电解要求,因此必须经过精制.
将粗盐水过滤以后再用化学药品作进一步的净化.
(1)下列化学药品中可以选用的是(填写代号)________.
A.Ba(NO3)2 B.BaCl2 C.NaOH D.K2CO3 E.Na2CO3 F.盐酸 G.硫酸
(2)所选的化学药品要按一定的先后顺序向盐水中加入,请按这个顺序写出有关的化学反应方程式(化学药品都是加到稍过量的程度)________.
(3)在你设计的加入化学药品先后顺序里,在加入某种化学药品之前,还必须增加一种物理除杂方法.这种化学药品的名称是________,这种物理除杂方法的名称是________.要在实验室中实施这种方法,所用到的玻璃质实验仪器一般是(写仪器名称)________.
(4)经过分析,上述净化盐水的方案合理无误.又通过更加精确的实验方法对净化以后的盐水进行成分分析,发现其仍然含有影响饱和食盐水电解的CaCl2和MgCl2,必须进一步地减少其含量.对此,下列说法中正确的是(填写代号)________.
A.对盐水进行重新过滤除杂
B.再从上述的(1)中选择化学药品用化学方法除杂
C.查阅资料或访问专家,采用更加科学先进的方法进行除杂
请按要求回答下列问题:
(1).某合作学习小组讨论辨析以下说法,其中说法正确的是 _____________
A根据酸分子中含有的氢原子个数,将酸分为一元酸、二元酸等
B 将Na2O2投入FeCl2溶液中, 可观察到的现象是生成红褐色沉淀、有气泡产生
C 金属元素的原子只有还原性,离子只有氧化性
D不锈钢和目前流通的硬币都是合金;
E NH3、CO2的水溶液均能导电,所以NH3、CO2均是电解质
(2)将5mol/L的Mg(NO3)2溶液a mL稀释至b mL,稀释后溶液中NO3-的物质的量浓度为_____________
(3)在K2Cr2O7+14HCl==2KCl+2CrCl3+3Cl2↑+7H2O反应中,
氧化剂是_____ _(填化学式) 当有14.6gHCl被氧化时,电子转移为 mol。
(4)学校研究性学习小组的同学,为测定某含镁3%~5%的铝镁合金(不含其他元素)中镁的质量分数,设计下列实验方案进行探究,填写下列空白:
实验方案:铝镁合金 ![]()
![]() 测定剩余固体质量。
测定剩余固体质量。
① 实验中发生反应的化学方程式是__________________。
② 实验步骤:称取5.4 g铝镁合金粉末样品,投入V mL 2.0 mol/L NaOH 溶液中充分反应。计算所用NaOH溶液的体积V≥______________。
过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将________( 填 不变 偏高 或 偏低 )。
查看习题详情和答案>>
下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L—1计算)。
| | 开始沉淀的pH | 沉淀完全的pH | 沉淀溶解的pH |
| Cu2+ | 4.4 | 6.4 | |
| Al3+ | 3.0 | 5.0 | 10 |
| Zn2+ | 5.9 | 8.9 | 11 |

②由表可知Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2—,请写出金属锌与氢氧化钠溶液反应的离子方程式
(2)为了符合绿色化学的要求,某研究性学习小组进行如下设计:
第一组:空气为氧化剂法
将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,即发生反应,生成硫酸铜。反应完全后,加入物质甲调节pH,铁元素全部沉淀(一般认为铁离子的浓度下降到10-5 mol·L-1,就认为沉淀完全。已知:Ksp[Fe((OH)3]≈10-38,然后过滤、浓缩、结晶。
请回答下列问题:
①方案为了使铁离子全部沉淀,应调节pH至少为 。
②方案中甲物质可选用的是
A.CaO B.NaOH C.CuCO3 D.Cu2(OH) 2CO3 E.Fe2(SO4) 3
③方案中加入少量FeSO4可加速铜的氧化,用离子方程式解释其原因 。
第二组:过氧化氢为氧化剂法
将铜粉放到 1.5 mol·L-1的足量稀硫酸中,控温在50℃加入10%的足量H2O2反应0.5 h,升温到60℃,持续反应1 h后,过滤、蒸发浓缩、减压抽滤等,用少量95%的酒精淋洗后晾干,得CuSO4·5H2O 。
请回答下列问题:
④用过氧化氢为氧化剂法比流程中采用硝酸和硫酸溶解的优点是 。
⑤用少量95%的酒精淋洗的目的是 。
(3)废铜溶解后经过一系列操作得到硫酸铜溶液,补充完整由溶解液制备纯净硫酸铜溶液的实验步骤 。
(14分)铝镁合金已成为飞机制造、化工生产等行业的重要材料。研究性学习小组的同学,为测定某含镁4%~6%的铝镁合金(不含其它元素)中镁的质量分数,设计了多种实验方案,其中之一是:将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。按要求填写下列空白:
1.称取5.4g铝镁合金粉末样品,溶于V mL 2.0 mol/L NaOH溶液中。
⑴实验中发生反应的化学方程式是 。
⑵为使其反应完全,则NaOH溶液的体积V ≥ mL。
2.过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将 。
(填“偏高”、“偏低”或“无影响”)。
3. NaOH溶液的浓度可用稀硫酸测定,欲用质量分数98%(密度为1.84 g/cm3)的浓硫酸配制3 mol/L的稀硫酸100 mL。回答下列问题:
⑴需要用量筒量取浓硫酸 mL。
⑵配制操作可分解成如下几步,正确的操作顺序是 。
A.继续往容量瓶中小心地加蒸馏水,使液面接近刻度线1~2cm时。
B.用少量蒸馏水洗涤烧杯及玻璃棒,将溶液注入容量瓶,并重复操作两次。
C.将冷却的稀硫酸转移到容量瓶中。
D.根据计算,用量筒取一定体积的浓硫酸。
E.将浓硫酸沿烧杯壁慢慢注入盛有蒸馏水的小烧杯中,并不断用玻璃棒搅拌。
F.盖上容量瓶塞子,振荡,摇匀。
G.用胶头滴管加蒸馏水,使溶液凹液面恰好与刻度线相切
⑶下列操作,使制得的稀硫酸溶液浓度偏小的是 (填写编号)。
A.用量筒量取一定液体时,俯视液面读数。
B.在容量瓶定容时俯视刻度线。
C.转移溶液后未洗涤烧杯和玻璃棒。
D.容量瓶刚用蒸馏水洗净,没有烘干。
E.定容时,滴加蒸馏水,先使液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切。
查看习题详情和答案>>