摘要:9.下列微粒中第一.第二层电子总和等于其第三.第四层电子总和的是 A. K B. Ca C. Mg D. S
网址:http://m.1010jiajiao.com/timu3_id_209705[举报]
有A、B、C、D、E五种元素,其中A、B、C属于同一周期,且原子序数B>C,A原子最外层p能级的电子数等于次外层的电子总数,B元素可分别与A、C、D、E生成常见的RB2型化合物,并知在DB2和EB2中,D与B的质量比为7:8,E与B的质量比为1:1.根据以上条件,回答下列问题:
(1)推断五种元素分别是(用元素名称回答):D
(2)指出C元素在元素周期表中的位置
(3)沸点DB2
(4)写出与EB3分子互为等电子体并含A、B、C任意两种元素的微粒
(5)通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,下列是一些键的键能:SiCl4(g)+2H2(g) 高温 Si(s)+4HCl(g) 通过计算该反应是
“放”)
查看习题详情和答案>>
(1)推断五种元素分别是(用元素名称回答):D
硅
硅
,E硫
硫
.(2)指出C元素在元素周期表中的位置
第二周期第ⅤA族
第二周期第ⅤA族
.E元素的最高价氧化物的分子构型为平面三角形
平面三角形
.(3)沸点DB2
>
>
EB2(填“>”、“<”或“=”等于),理由SiO2是原子晶体,SO2是分子晶体,故沸点SiO2>SO2
SiO2是原子晶体,SO2是分子晶体,故沸点SiO2>SO2
(4)写出与EB3分子互为等电子体并含A、B、C任意两种元素的微粒
NO3-
NO3-
(填1种)(5)通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,下列是一些键的键能:SiCl4(g)+2H2(g) 高温 Si(s)+4HCl(g) 通过计算该反应是
吸
吸
热(填“吸”或“放”)
236
236
kJ/mol| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/kJ?mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
 有U、V、W、X、Y、Z、T七种前四周期元素,它们的原子序数依次增大,其相关信息如下表:
有U、V、W、X、Y、Z、T七种前四周期元素,它们的原子序数依次增大,其相关信息如下表:| 元素编号 | 相 关 信 息 |
| U | 其核外电子总数等于其电子层数 |
| V | 基态时,电子分布在三个能级上,且各能级中电子数均相等 |
| W | 其单质是空气的主要成分之一,且化学性质相当稳定 |
| X | 与W元素处于同一周期,且X的第一电离能小于W的第一电离能 |
| Y | 其单质是最强的氧化剂 |
| Z | Z元素的二价阳离子与氩原子的电子层结构相同 |
| T | 是第四周期元素中未成对电子数最多的元素 |
(1)T的基态原子的价电子排布式为
(2)U、V两种元素可组成多种结构的分子.请写出符合下列条件的物质的结构简式:
若化合物V8U8中V元素均采取sp3杂化方式
若化合物V8U8中V元素均采取sp2杂化方式
(3)写出一种与V22-互为等电子体的分子的化学式为
(4)甲和乙分别是W、X元素对应的氢化物,甲和乙中均属于10电子分子,甲极易溶于乙中,原因是
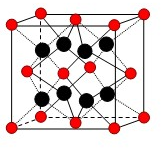
(5)ZY2晶体的晶胞如图所示,Z2+位于晶胞的顶点和面心,则Z2+的配位数为