摘要:30.4.2g铁和氧气化合生成了铁的氧化物5.8克.试求出化合物的化学式?
网址:http://m.1010jiajiao.com/timu3_id_20913[举报]
氧化物、酸、碱、盐都是重要的无机化合物.请按要求回答下列一系列相关的问题.
(1)产生下列现象,只和空气中的水蒸气有关的是______
A.固体烧碱要密封存放
B.生石灰长期在空气中放置会变质
C.浓硫酸露置于空气中会增重、变稀
D.铁制品放在潮湿空气中会生锈
(2)以下是一些食物的近似pH,对于胃酸过多的人比较适宜的食物是______
| 选项 | A | B | C | D |
| 物质 | 橘子 | 泡菜 | 葡萄 | 玉米粥 |
| pH | 2.9~3.5 | 3.0~4.0 | 3.5~4.5 | 6.8-8.0 |
A.稀释浓硫酸时,为什么不可将水倒进浓硫酸里?请简要解释其原因.
B.盐酸等许多酸都能使紫色石蕊试液变红,为什么?
C.写出用稀盐酸除水垢(主要成分是碳酸钙)的化学方程式.
(4)三支试管中分别装有少量白色固体,它们分别是氯化钠、氢氧化钠、碳酸钙中的一种,只要加入足量的______就能将它们一次性鉴别出来;盐酸(分析纯)化学式HCl质量分数36%密度l.18g/cm3
(5)实验操作考试时某同学做了如下两个实验:①氧化铜与稀硫酸反应;②烧碱溶液与酚酞溶液反应.实验结束后,该同学发现废液缸中有蓝色沉淀.请你写出有蓝色沉淀生成的反应的化学方程式是______.
(6)右图是浓盐酸试剂瓶上标签的部分内容.请回答:
A.现要配制9%的稀盐酸120g,需要这种浓盐酸______g;
B.浓盐酸使用一段时间后溶质质量分数变小的原因是什么?
C.某固体氢氧化钠在空气中敞口放置一段时间后部分变质,将该固体取10g加入质量分数为9%的盐酸至不再产生气泡为止,共产生气体质量为2.2g,试计算未变质的氢氧化钠的质量为多少克? 查看习题详情和答案>>
钢铁的冶炼是人类文明的一个重要标志.图1是实验室模拟炼铁的装置图.
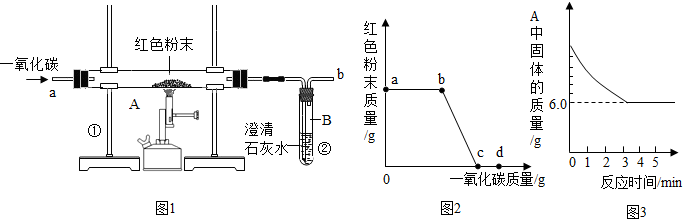
(1)写出图1中A处发生的化学反应方程式:
(2)实验过程中通入CO质量与红色粉末质量的关系如图2所示.根据图示,下列说法不正确的是
①a点表示开始通入CO,反应开始发生;
②b点表示通入CO一段时间后加热,反应开始发生;
③c点表示红色粉末已充分参加反应;
④d点表示反应结束后仍需继续通入CO;
⑤可根据通入CO的质量计算出红色粉末的质量.
(3)图1装置中的不足之处是
(4)该实验炼制的铁与工业炼制出的铁最大的区别是
(5)某化学小组的同学们利用上述实验对一份固体样品进行了探究.通过实验已确定该样品由氧化铁和铁粉混合而成.他们取了7.2g固体样品,用图1所示的装置重新实验,测定的部分数据如图3所示,则原样品中铁元素与氧元素的质量比是
查看习题详情和答案>>

(1)写出图1中A处发生的化学反应方程式:
Fe2O3+3CO
2Fe+3CO2
| ||
Fe2O3+3CO
2Fe+3CO2
;
| ||
(2)实验过程中通入CO质量与红色粉末质量的关系如图2所示.根据图示,下列说法不正确的是
①⑤
①⑤
;(填序号)①a点表示开始通入CO,反应开始发生;
②b点表示通入CO一段时间后加热,反应开始发生;
③c点表示红色粉末已充分参加反应;
④d点表示反应结束后仍需继续通入CO;
⑤可根据通入CO的质量计算出红色粉末的质量.
(3)图1装置中的不足之处是
没有对尾气进行处理
没有对尾气进行处理
.(4)该实验炼制的铁与工业炼制出的铁最大的区别是
该实验炼制的铁是纯净物,工业炼制的生铁是混合物,含有一定量的碳
该实验炼制的铁是纯净物,工业炼制的生铁是混合物,含有一定量的碳
.(5)某化学小组的同学们利用上述实验对一份固体样品进行了探究.通过实验已确定该样品由氧化铁和铁粉混合而成.他们取了7.2g固体样品,用图1所示的装置重新实验,测定的部分数据如图3所示,则原样品中铁元素与氧元素的质量比是
5:1
5:1
.同学们为了研究氧化铁能否在氯酸钾制取氧气的实验中起催化作用,进行了以下实验:
【资料】
①氯酸钾分解反应的化学方程式为 2KClO3
2KCl+3O2↑.
②氯酸钾和氯化钾均能溶于水.
【实验一】氧化铁能否在氯酸钾制取氧气实验中加快反应速率.
(1)实验3中氧化铁的质量为 .
(2)以上实验采用了 的实验方法.
(3)实验一得到的结论是 .
【实验二】为证明氧化铁是该反应的催化剂,同学们又完成了以下的实验:
Ⅰ.在实验3反应后的混合物中加足量的水溶解,过滤得到红色固体,洗涤干燥并用电子天平称量,质量为0.2g.
Ⅱ.将一定量的CO通入滤出的固体,按如图进行实验:
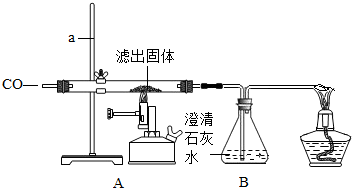
甲同学的实验报告如下:
(4)写出A中玻璃管内发生反应的化学方程式 .
【实验结论】氧化铁能在氯酸钾制取氧气反应中起催化剂.
【实验反思】乙同学查阅资料发现一氧化碳还原氧化铁后剩余固体可能由氧化亚铁、四氧化三铁、铁粉和未反应的氧化铁中的一种或几种组成.
为了研究剩余固体的成分,丙同学查阅了以下资料:
(5)丙同学认为剩余固体中一定没有氧化铁,原因是 .
(6)测定剩余固体的组成.
查看习题详情和答案>>
【资料】
①氯酸钾分解反应的化学方程式为 2KClO3
| ||
| △ |
②氯酸钾和氯化钾均能溶于水.
【实验一】氧化铁能否在氯酸钾制取氧气实验中加快反应速率.
| 实验编号 | KClO3/g | 氧化物 | 产生气体的体积(mL) | 耗时(s) |
| 1 | 0.6 | / | 67 | 1800 |
| 2 | 0.6 | 0.2g二氧化锰 | 67 | 36.5 |
| 3 | 0.6 | 67 | 89.5 |
(2)以上实验采用了
(3)实验一得到的结论是
【实验二】为证明氧化铁是该反应的催化剂,同学们又完成了以下的实验:
Ⅰ.在实验3反应后的混合物中加足量的水溶解,过滤得到红色固体,洗涤干燥并用电子天平称量,质量为0.2g.
Ⅱ.将一定量的CO通入滤出的固体,按如图进行实验:

甲同学的实验报告如下:
| 装置 | 实验现象 | 实验分析 |
| A | 红色固体全部变黑 | 生成了铁 |
| B | 石灰水变浑浊 | 产生二氧化碳 |
【实验结论】氧化铁能在氯酸钾制取氧气反应中起催化剂.
【实验反思】乙同学查阅资料发现一氧化碳还原氧化铁后剩余固体可能由氧化亚铁、四氧化三铁、铁粉和未反应的氧化铁中的一种或几种组成.
为了研究剩余固体的成分,丙同学查阅了以下资料:
| 铁粉 | 氧化亚铁 | 氧化铁 | 四氧化三铁 | |
| 颜色 | 黑色 | 黑色 | 红色 | 黑色 |
| 磁性 | 有 | 无 | 无 | 有 |
| 与CO反应 | 不反应 | 反应 | 反应 | 反应 |
| 与稀盐酸反应 | 反应 | 生成氯化亚铁和水 | 生成氯化铁和水 | 生成氯化亚铁、氯化铁和水 |
| 与硫酸铜溶液反应 | 反应 | 不反应 | 不反应 | 不反应 |
(6)测定剩余固体的组成.
| 步骤 | 实验操作 | 实验现象 | 结论和解释 |
| 1 | 用磁铁吸引剩余固体 | 剩余固体中没有氧化亚铁. | |
| 2 | 剩余固体中只有铁粉. |
同学们为了研究氧化铁能否在氯酸钾制取氧气的实验中起催化作用,进行了以下实验:
【资料】①氯酸钾分解反应的化学方程式为 2KClO3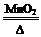 2KCl+3O2↑。
2KCl+3O2↑。
②氯酸钾和氯化钾均能溶于水。
【实验一】氧化铁能否在氯酸钾制取氧气实验中加快反应速率。
| 实验编号 | KClO3/g | 氧化物 | 产生气体的体积(mL) | 耗时(s) |
| 1 | 0.6 | | 67 | 1800 |
| 2 | 0.6 | 0.2g二氧化锰 | 67 | 36.5 |
| 3 | 0.6 | g 氧化铁 | 67 | 89.5 |
(1)实验3中氧化铁的质量为 。
(2)以上实验采用了 的实验方法。
(3)实验一得到的结论是 。
【实验二】为证明氧化铁是该反应的催化剂,同学们又完成了以下的实验:
Ⅰ.在实验3反应后的混合物中加足量的水溶解,过滤得到红色固体,洗涤干燥并用电子天平称量,质量为0.2g。
Ⅱ.将一定量的CO通入滤出的固体,按下图进行实验:

甲同学的实验报告如下:
| 装置 | 实验现象 | 实验分析 |
| A | 红色固体全部变黑 | 生成了铁 |
| B | 石灰水变浑浊 | 产生二氧化碳 |
(4)写出A中玻璃管内发生反应的化学方程式 。
【实验结论】氧化铁能在氯酸钾制取氧气反应中起催化剂。
【实验反思】乙同学查阅资料发现一氧化碳还原氧化铁后剩余固体可能由氧化亚铁、四氧化三铁、铁粉和未反应的氧化铁中的一种或几种组成。
为了研究剩余固体的成分,丙同学查阅了以下资料:
| | 铁粉 | 氧化亚铁 | 氧化铁 | 四氧化三铁 |
| 颜色 | 黑色 | 黑色 | 红色 | 黑色 |
| 磁性 | 有 | 无 | 无 | 有 |
| 与CO反应 | 不反应 | 反应 | 反应 | 反应 |
| 与稀盐酸反应 | 反应 | 生成氯化亚铁和水 | 生成氯化铁和水 | 生成氯化亚铁、氯化铁和水 |
| 与硫酸铜溶液反应 | 反应 | 不反应 | 不反应 | 不反应 |
(5)丙同学认为剩余固体中一定没有氧化铁,原因是____________。
(6)测定剩余固体的组成。
| 步骤 | 实验操作 | 实验现象 | 结论和解释 |
| 1 | 用磁铁吸引剩余固体 | _____________ | 剩余固体中没有氧化亚铁。 |
| 2 | __________________ | ______________ | 剩余固体中只有铁粉。 |
同学们为了研究氧化铁能否在氯酸钾制取氧气的实验中起催化作用,进行了以下实验:
【资料】①氯酸钾分解反应的化学方程式为 2KClO3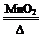 2KCl+3O2↑。
2KCl+3O2↑。
②氯酸钾和氯化钾均能溶于水。
【实验一】氧化铁能否在氯酸钾制取氧气实验中加快反应速率。
(1)实验3中氧化铁的质量为 。
(2)以上实验采用了 的实验方法。
(3)实验一得到的结论是 。
【实验二】为证明氧化铁是该反应的催化剂,同学们又完成了以下的实验:
Ⅰ.在实验3反应后的混合物中加足量的水溶解,过滤得到红色固体,洗涤干燥并用电子天平称量,质量为0.2g。
Ⅱ.将一定量的CO通入滤出的固体,按下图进行实验:

甲同学的实验报告如下:
(4)写出A中玻璃管内发生反应的化学方程式 。
【实验结论】氧化铁能在氯酸钾制取氧气反应中起催化剂。
【实验反思】乙同学查阅资料发现一氧化碳还原氧化铁后剩余固体可能由氧化亚铁、四氧化三铁、铁粉和未反应的氧化铁中的一种或几种组成。
为了研究剩余固体的成分,丙同学查阅了以下资料:
(5)丙同学认为剩余固体中一定没有氧化铁,原因是____________。
(6)测定剩余固体的组成。
【资料】①氯酸钾分解反应的化学方程式为 2KClO3
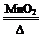 2KCl+3O2↑。
2KCl+3O2↑。②氯酸钾和氯化钾均能溶于水。
【实验一】氧化铁能否在氯酸钾制取氧气实验中加快反应速率。
| 实验编号 | KClO3/g | 氧化物 | 产生气体的体积(mL) | 耗时(s) |
| 1 | 0.6 | | 67 | 1800 |
| 2 | 0.6 | 0.2g二氧化锰 | 67 | 36.5 |
| 3 | 0.6 | g 氧化铁 | 67 | 89.5 |
(1)实验3中氧化铁的质量为 。
(2)以上实验采用了 的实验方法。
(3)实验一得到的结论是 。
【实验二】为证明氧化铁是该反应的催化剂,同学们又完成了以下的实验:
Ⅰ.在实验3反应后的混合物中加足量的水溶解,过滤得到红色固体,洗涤干燥并用电子天平称量,质量为0.2g。
Ⅱ.将一定量的CO通入滤出的固体,按下图进行实验:

甲同学的实验报告如下:
| 装置 | 实验现象 | 实验分析 |
| A | 红色固体全部变黑 | 生成了铁 |
| B | 石灰水变浑浊 | 产生二氧化碳 |
(4)写出A中玻璃管内发生反应的化学方程式 。
【实验结论】氧化铁能在氯酸钾制取氧气反应中起催化剂。
【实验反思】乙同学查阅资料发现一氧化碳还原氧化铁后剩余固体可能由氧化亚铁、四氧化三铁、铁粉和未反应的氧化铁中的一种或几种组成。
为了研究剩余固体的成分,丙同学查阅了以下资料:
| | 铁粉 | 氧化亚铁 | 氧化铁 | 四氧化三铁 |
| 颜色 | 黑色 | 黑色 | 红色 | 黑色 |
| 磁性 | 有 | 无 | 无 | 有 |
| 与CO反应 | 不反应 | 反应 | 反应 | 反应 |
| 与稀盐酸反应 | 反应 | 生成氯化亚铁和水 | 生成氯化铁和水 | 生成氯化亚铁、氯化铁和水 |
| 与硫酸铜溶液反应 | 反应 | 不反应 | 不反应 | 不反应 |
(5)丙同学认为剩余固体中一定没有氧化铁,原因是____________。
(6)测定剩余固体的组成。
| 步骤 | 实验操作 | 实验现象 | 结论和解释 |
| 1 | 用磁铁吸引剩余固体 | _____________ | 剩余固体中没有氧化亚铁。 |
| 2 | __________________ | ______________ | 剩余固体中只有铁粉。 |