摘要:0.25mol/L H2SO4溶液10mL与0.5mol/L NaOH溶液10mL混合后.在加水稀释为100mL.各取少量分别加入有关指示剂.呈现颜色正确的是: (1)甲基橙��黄色,(2)酚酞��红色, (3)石蕊��红色,(4)酚酞��无色, A. C.
网址:http://m.1010jiajiao.com/timu3_id_208607[举报]
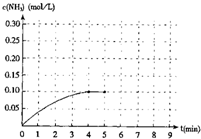 在一容积为2升的密闭容器内加入0.2mol的N2和0.6mol 的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)+Q(Q>0).反应中NH3的物质的量浓度的变化的情况如右图:
在一容积为2升的密闭容器内加入0.2mol的N2和0.6mol 的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)+Q(Q>0).反应中NH3的物质的量浓度的变化的情况如右图:(1)根据右图,计算从反应开始到平衡时,平均反应速率v(NH3)为
(2)该反应的化学平衡常数表达式为
(3)反应达到平衡后,第5分钟时,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为
A、0.20mol/L B、0.16mol/L C、0.10mol/L D、0.05mol/L
(4)反应达到平衡后,第5分钟时,保持其它条件不变,若只把容器的体积缩小一半,平衡
(5)第5分钟把容器的体积缩小一半后,若在第8分钟达到新的平衡(此时NH3的浓度约为0.25mol/L),请在上图中画出第5分钟到此平衡时NH3浓度的变化曲线.
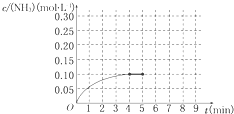
 (2013?广东模拟)在一固定容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0.反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
(2013?广东模拟)在一固定容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0.反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:(1)根据下图,计算从反应开始到平衡时,平均反应速率v(NH3)=
0.025mol/(L?min)
0.025mol/(L?min)
.(2)该反应450℃的平衡常数
>
>
500℃时的平衡常数(填“>”、“<”或“=”).(3)下列描述中能说明上述反应已达平衡的是
BD
BD
.A.3v正(H2)=2v逆(NH3)
B.容器中气体的平均相对分子量不随时间而变化
C.容器中气体的密度不随时间而变化
D.容器中气体的分子总数不随时间而变化
(4)第5分钟末,保持恒温恒压,若继续通入0.2mol的N2和0.6mol的H2,平衡
不
不
移动(填“向正反应方向”、“向逆反应方向”或“不”).(5)第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡
(此时NH3浓度约为0.25mol/L),请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线.
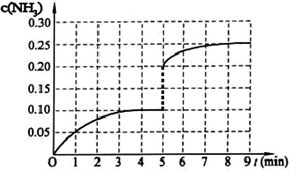

 在一容积为2L的密闭容器中,加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题:
在一容积为2L的密闭容器中,加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题:(1)根据如图,计算从反应开始到平衡时,平衡反应速率v(NH3)为
0.025
0.025
mol/(L?min).(2)该反应达到平衡时H2的转化率
50%
50%
.(3)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为
a
a
.(填序号)a.0.20mol?L-1 b.0.12mol?L-1 c.0.10mol?L-1 d.0.08mol?L-1
(4)反应达到平衡后,第5分钟末,保持其它条件不变,若只把容器的体积缩小一半,平衡
向正反应方向
向正反应方向
移动(填“向逆反应方向”、“向正反应方向”或“不”).(5)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25mol?L-1),请在图中画出第5分钟末到此平衡时NH3浓度的变化曲线.
(2009?滨州模拟)在一容积为2L的密闭容器中,加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:
N2(g)+3H2(g)
2NH3(g)△HPO反应中NH3的物质的量浓度的变化情况如图所示:请回答下列问题;

(1)根据如图,计算从反应开始到平衡时,平均反应速率v(NH3)为
(2)该反应的化学平衡常数表达式K
.
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为
a 0.20mol?L-1 b 0.12mol?L-1 c 0.10mol?L-1 d 0.08mol?L-1
(4)反应达到平衡后,第5分钟末,保持其它条件不变,若只把容器的体积缩小一半,平衡
(6)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25mol?L-1 ),请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线.
查看习题详情和答案>>
N2(g)+3H2(g)
| ||

(1)根据如图,计算从反应开始到平衡时,平均反应速率v(NH3)为
0.025mol/(L?min)
0.025mol/(L?min)
.(2)该反应的化学平衡常数表达式K
| c2(NH3) |
| c(N2)×c3(H2) |
| c2(NH3) |
| c(N2)×c3(H2) |
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为
ac
ac
.(填序号).a 0.20mol?L-1 b 0.12mol?L-1 c 0.10mol?L-1 d 0.08mol?L-1
(4)反应达到平衡后,第5分钟末,保持其它条件不变,若只把容器的体积缩小一半,平衡
向正反应方向
向正反应方向
移动(填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数不变
不变
(填“增大”、“减少”或“不变”).(6)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25mol?L-1 ),请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线.
在一定温度下,向一容积为2L升的恒容密闭容器内加入0.2mol的N2和0.6mol的H2,发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0.反应中NH3的物质的量浓度的变化的情况如图所示:
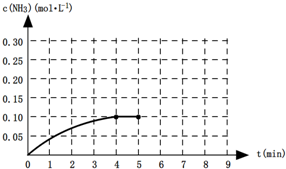
(1)根据上图,计算从反应开始到平衡时,平均反应速率v(NH3)= .
(2)反应达到平衡后,第5分钟时,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为 (选填字母编号).
a.0.20mol?L-1 b.0.16mol?L-1 c.0.10mol?L-1 d.0.05mol?L-1
(3)该反应的化学平衡常数表达式为 .反应达到平衡后,第5分钟时,若保持其它条件不变,只把容器的体积缩小一半,平衡 移动(选填“正向”、“逆向”或“不”),化学平衡常数K (选填“增大”、“减小”或“不变”).
(4)第5分钟时把容器的体积缩小一半后,若在第8分钟达到新的平衡(此时NH3的浓度约为0.25mol?L-1),请在图中画出从第5分钟开始变化直至到达新平衡时NH3浓度的变化曲线.
(5)常温下,向0.001mol?L-1的AlCl3 溶液中通入NH3直至过量,现象 ,当pH= 时,开始生成沉淀(已知:Ksp[Al(OH)3]=1.0×10-33).
查看习题详情和答案>>

(1)根据上图,计算从反应开始到平衡时,平均反应速率v(NH3)=
(2)反应达到平衡后,第5分钟时,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为
a.0.20mol?L-1 b.0.16mol?L-1 c.0.10mol?L-1 d.0.05mol?L-1
(3)该反应的化学平衡常数表达式为
(4)第5分钟时把容器的体积缩小一半后,若在第8分钟达到新的平衡(此时NH3的浓度约为0.25mol?L-1),请在图中画出从第5分钟开始变化直至到达新平衡时NH3浓度的变化曲线.
(5)常温下,向0.001mol?L-1的AlCl3 溶液中通入NH3直至过量,现象