摘要:(1)K2CO3+H2SO4K2SO4+H2O+CO2↑ (2)AgNO3十NaClAgCl↓+NaNO3 (3)CuSO4+2NaOHNa2SO4+Cu(OH)2↓ (4)SO2+2NaOHNa2SO3十H2O
网址:http://m.1010jiajiao.com/timu3_id_208602[举报]
 (2013?珠海一模)(1)将不同量的CO(g)和H2O(g)分别通入体积2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如下两组数据:
(2013?珠海一模)(1)将不同量的CO(g)和H2O(g)分别通入体积2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如下两组数据:| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
0.13mol/(L?min)
0.13mol/(L?min)
(第二位小数)②该反应为
放热
放热
(填“吸热”或“放热”)反应.③求实验2的平常常数K,要求写出计算过程,结果取二位小数
(2)已知在常温常压下:①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1451.6kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
写出甲醇不完全燃烧生成CO和液态水的热化学方程式
CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ/mol
CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ/mol
(3)甲醇和氧气完全燃烧的反应可以设计为燃料电池,装置如图,该电池通过K2CO3溶液吸收反应生的CO2.则负极的电极反应为
CH3OH+7CO32-+2H2O-6e-=8HCO3-
CH3OH+7CO32-+2H2O-6e-=8HCO3-
.(4)CaCO3的KSP=2.8×10-9.将等体积CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mol/L,则生成沉淀所需该CaCl2溶液的最小浓度为
5.6×10-5mol/L
5.6×10-5mol/L
.A、B、C、D、E、F属于短周期主族元素.A的原子半径在短周期中最大,B的一种原子中,质量数与质子数之差为零,C与D、E与F均同主族,C元素的原子L层电子数是K层的2倍,E原子的核外电子总数等于C、D原子核外电子总数的差.
(1)离子B-的结构示意图为
 ;化合物CE2的分子属于
;化合物CE2的分子属于
 .
.
(2)A、E、F形成的简单离子的半径由大到小的顺序为
(3)由B、C可以构成的最简单的化合物W,取16.0g分子式为W?8H2O的化合物,将其释放的W完全燃烧生成液态水,可放出89.03kJ的热量,则W燃烧的热化学方程式为
(4)使液化石油气氧化直接产生电流是新世纪最富有挑战性的课题之一.有人设计制造了一种燃料电池,一个电极通入富含E单质的气体和少量CE2,另一电极通入液化石油气(以C4H10表示),电池的电解质是熔融的K2CO3.该电池的负极反应式为
查看习题详情和答案>>
(1)离子B-的结构示意图为


非极性
非极性
分子(填“极性”或“非极性”);用电子式表示化合物A2F的形成过程

(2)A、E、F形成的简单离子的半径由大到小的顺序为
S2->O2->Na+
S2->O2->Na+
(用离子符号表示);元素C、D、E形成的常见单质中,熔沸点由高到低的顺序是(用名称表示)金刚石(石墨)>晶体硅>氧气
金刚石(石墨)>晶体硅>氧气
.(3)由B、C可以构成的最简单的化合物W,取16.0g分子式为W?8H2O的化合物,将其释放的W完全燃烧生成液态水,可放出89.03kJ的热量,则W燃烧的热化学方程式为
CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H=-890kJ?mol-1
CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H=-890kJ?mol-1
.(4)使液化石油气氧化直接产生电流是新世纪最富有挑战性的课题之一.有人设计制造了一种燃料电池,一个电极通入富含E单质的气体和少量CE2,另一电极通入液化石油气(以C4H10表示),电池的电解质是熔融的K2CO3.该电池的负极反应式为
C4H10+13O2--26e-=4CO2+5H2O
C4H10+13O2--26e-=4CO2+5H2O
,电池工作时,电解质里的CO32-向负
负
极移动.某化学兴趣小组在课外活动中,对某溶液进行了三次检验,每次检验结果如下表所示,请回答下列问题.
(1)三次检验结果中第
(2)检验时,为了证明溶液中存在SO42-、Cl-、CO32-,进行下列实验:(填写下列空白)
(3)步骤1中溶液滴加过量的目的是
查看习题详情和答案>>
| 检验次数 | 溶液中检验出的物质 |
| 第一次 | KCl、K2SO4、Na2CO3、NH4Cl |
| 第二次 | NH4Cl、BaCl2、Na2SO4、K2CO3 |
| 第三次 | Na2SO4、NH4Cl、K2CO3、NaCl |
二
二
次检验结果不正确.(2)检验时,为了证明溶液中存在SO42-、Cl-、CO32-,进行下列实验:(填写下列空白)
| 步骤 | 实验操作 | 预期现象及结论 |
| 1 | 向溶液中滴加 HNO3 HNO3 (填化学式)溶液至过量 |
有气体生成,证明溶液中含有CO32- 有气体生成,证明溶液中含有CO32- |
| 2 | 向上述溶液中滴加Ba(NO3)2溶液至过量 向上述溶液中滴加Ba(NO3)2溶液至过量 |
产生白色沉淀,证明溶液中含SO42- 产生白色沉淀,证明溶液中含SO42- |
| 3 | 过滤,再向滤液中加入 AgNO3 AgNO3 (填化学式)溶液 |
产生白色沉淀,证明溶液中含Cl- 产生白色沉淀,证明溶液中含Cl- |
除尽溶液中的CO32-,以免干扰下一步实验
除尽溶液中的CO32-,以免干扰下一步实验
;如何判断步骤2中的溶液已加过量静置,往上层清液中继续滴加Ba(NO3)2溶液,若无白色沉淀生成,则Ba(NO3)2溶液已滴加过量
静置,往上层清液中继续滴加Ba(NO3)2溶液,若无白色沉淀生成,则Ba(NO3)2溶液已滴加过量
.
甲醇可作为燃料电池的原料.通过下列反应可以制备甲醇:CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ?mol-1
在一容积可变的密闭容器中充入10mol CO 和20mol H2,CO的平衡转化率随温度(T)、压强(P)的变化如图1所示,当达到平衡状态A 时,容器的体积为20L.
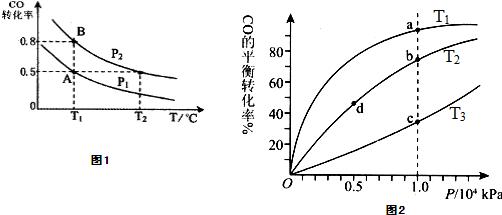
(1)T1℃反应的平衡常数为 .
(2)图中P1 P2(填“>”、“<”或“=”).
(3)如反应开始时仍充入10mol CO和20mol H2,则在平衡状态B时容器的体积V(B)= L.
(4)关于反应CO(g)+2H2(g)?CH3OH(g)在化学平衡状态时的描述正确的是 (填字母,下同).
A.CO的含量保持不变 B.容器中CH3OH浓度与CO浓度相等
C.2v正(CH3OH)=v正(H2) D.容器中混合气体的平均相对分子质量保持不变
(5)CO(g)+2H2(g)?CH3OH(g),按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图2所示.下列说法正确的是 .
A.温度:T1<T2<T3
B.正反应速率:v(a)>ν(c); v(b)>v(d)
C.平衡常数:K(a)=K(c); K(b)>K(d)
D.平均摩尔质量:M(a)<M(c); M(b)>M(d)
(6)已知CO2(g)+H2(g)?CO(g)+H2O(g)△H=+41.3kJ?mol-1,试写出由CO2和H2制取甲醇的热化学方程式 .
(7)以甲醇、CO2、空气、熔融盐K2CO3组成燃料电池,写出该电池负极的电极反应式: .
查看习题详情和答案>>
在一容积可变的密闭容器中充入10mol CO 和20mol H2,CO的平衡转化率随温度(T)、压强(P)的变化如图1所示,当达到平衡状态A 时,容器的体积为20L.

(1)T1℃反应的平衡常数为
(2)图中P1
(3)如反应开始时仍充入10mol CO和20mol H2,则在平衡状态B时容器的体积V(B)=
(4)关于反应CO(g)+2H2(g)?CH3OH(g)在化学平衡状态时的描述正确的是
A.CO的含量保持不变 B.容器中CH3OH浓度与CO浓度相等
C.2v正(CH3OH)=v正(H2) D.容器中混合气体的平均相对分子质量保持不变
(5)CO(g)+2H2(g)?CH3OH(g),按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图2所示.下列说法正确的是
A.温度:T1<T2<T3
B.正反应速率:v(a)>ν(c); v(b)>v(d)
C.平衡常数:K(a)=K(c); K(b)>K(d)
D.平均摩尔质量:M(a)<M(c); M(b)>M(d)
(6)已知CO2(g)+H2(g)?CO(g)+H2O(g)△H=+41.3kJ?mol-1,试写出由CO2和H2制取甲醇的热化学方程式
(7)以甲醇、CO2、空气、熔融盐K2CO3组成燃料电池,写出该电池负极的电极反应式: