摘要:20. 短周期元素A.B.C.D.E的原子序数依次增大.其中B和E同主族.A元素的最高正价和最低负价的绝对值之差为2,1 mol C单质能与冷水反应.在标准状况下生成11.2 L H2,D原子最外层电子数等于周期序数,E-的电子层结构与氩原子相同. (1) A元素在周期表中的位置是第 周期 族, (2) E-的离子结构示意图为 , (3) D的最高价氧化物是 (填“酸性 .“碱性 或“两性 )氧化物,该氧化物与C的最高价氧化物对应水化物反应的化学方程式为 . (4) 比较元素非金属性强弱的方法很多.下列关于B和E的非金属性强弱研究方案中可行的是 . A.比较两种单质的颜色 B.比较氢化物的稳定性 C.依据两元素在周期表中的位置
网址:http://m.1010jiajiao.com/timu3_id_208079[举报]
短周期元素A、B、C、D、E的原子序数依次增大,其元素特征信息如下表:
(1)E的简单离子的结构示意图为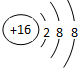
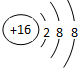 ;
;
(2)D在周期表中的位置为
(3)B和C简单离子的半径大小为
(4)元素非金属性强弱比较有很多方法,其中B和E的非金属性强弱的研究方案中不可行的是
a.比较两种单质的颜色 b.比较氢化物的稳定性
c.依据两元素在周期表中的位置 d.依据两元素单质在自然界中的存在状态
(5)B元素均可与另外四种元素中的一种形成化合物,其中只含离子键的是
查看习题详情和答案>>
| 元素编号 | 元素特征信息 |
| A | 最高正价和最低负价的绝对值之差为2 |
| B | 最外层电子数是内层电子数的3倍 |
| C | 1molC单质能与冷水反应,在标准状况下生成11.2LH2 |
| D | 原子最外层电子数等于其周期序数 |
| E | 负二价阴离子的电子层结构与Ar原子相同 |
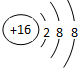
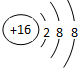
(2)D在周期表中的位置为
第三周期IIIA族
第三周期IIIA族
;(3)B和C简单离子的半径大小为
O2->Na+
O2->Na+
;(用离子符号和“>”、“=”或“<”表示)(4)元素非金属性强弱比较有很多方法,其中B和E的非金属性强弱的研究方案中不可行的是
ad
ad
(填序号);a.比较两种单质的颜色 b.比较氢化物的稳定性
c.依据两元素在周期表中的位置 d.依据两元素单质在自然界中的存在状态
(5)B元素均可与另外四种元素中的一种形成化合物,其中只含离子键的是
Na2O、Al2O3
Na2O、Al2O3
(写化学式,下同),既含离子键又含共价键的是Na2O2
Na2O2
.短周期元素A、B、C、D、E的原子序数依次增大,A的一种同位素的质量数为1,A和B同主族,C原子的最外层电子数是电子层数的3倍,D的最高正价与最低负价的绝对值相等,E的最高价氧化物的水化物的化学式为HnEO2n+2.下列说法正确的是( )
| A、A-离子半径小于B+离子半径 | B、B单质在C单质中燃烧生成原子个数比为1:1的化合物 | C、D的氧化物为酸性氧化物,溶于水可制得D的含氧酸 | D、D与E组成的化合物中,各原子最外层均达到8电子结构 |
短周期元素A、B、C、D、E的原子序数依次增大,A元素阳离子的原子核外没有电子;B是空气中含量最多的元素;C元素原子最外层电子数是其电子层数的三倍;C与D可形成两种常见的离子化合物;工业上常用电解C与E的化合物来制备E单质.下列说法错误的是( )
查看习题详情和答案>>
短周期元素A、B、C、D、E的原子序数依次增大,它们的原子核外电子层数之和为10;B的化合物种类繁多,数目庞大;C、D是空气中含量最多的两种元素;D、E两单质可以生成两种不同的离子化合物。
(1)写出E的单质与A2D反应的离子方程式______________。
(2)由A、C、D三元素所形成的常见盐溶液呈______________性(填“酸”“中”“碱”),其原因用离子方程式表示为:__________________________________________。
(3)B的相对分子质量最小的氢化物的燃烧热为890.3 kJ/mol,写出其燃烧的热化学方程式。
(4)X、Y是均由C、D两元素组成的化合物,且C、D在X、Y中的价态相同,某温度下相互转化时的量变关系如下图:X的化学式是______________,图中a、b、c、d四点中,表示反应处于平衡状态的是,该温度下______________,反应Y转化为X的平衡常数为______________,反应进程到t2时刻,改变的条件可能是___________________________。
