摘要:19.将5mol·L-1 盐酸10mL稀释到200mL.再取出5mL.这5mL溶液的物质的量浓度是 A.0.05mol/L B.0.25mol/L C.0.1mol/L D.0.5mol/L
网址:http://m.1010jiajiao.com/timu3_id_207807[举报]
 元素氯及其化合物在生产、生活、科研中有广泛的应用.
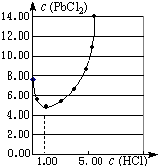
元素氯及其化合物在生产、生活、科研中有广泛的应用.(1)25℃时,PbCl2固体在不同浓度盐酸(mol?L-1)中的溶解度(mmol?L-1)如图所示.
①在制备PbCl2的实验中,洗涤PbCl2固体最好选用
a.蒸馏水 b.1mol?L-1盐酸
c.5mol?L-1盐酸 d.10mol?L-1盐酸
②当盐酸的浓度小于1mol?L-1时,随着盐酸浓度的增大,PbCl2的溶解度减小,其原因是
(2)TCCA广泛用于漂白、杀菌消毒,其学名为三氯均三嗪-2,4,6-三酮,分子式为C3Cl3N3O3.
①TCCA分子具有完全对称的结构,并含有一个六元环,则其结构简式为
②使用TCCA时,需先将该物质溶解于水,其水解产物之一为C3H3N3O3,另一种产物具有强氧化性,能够杀菌消毒.写出另一种产物的电子式
(3)高氯酸铵(AP)作为一种优良的固体推进剂被用于导弹和火箭发射.目前,较为先进的制备方法是电解高纯次氯酸得到高纯高氯酸,再与高纯氨进行喷雾反应制成高氯酸铵.写出由次氯酸电解制备高氯酸的阳极反应式:
已知:在25时H2O?H++OH-,KW=10-14;CH3COOH?H++CH3COO-,Ka=1.8×10-5
(1)取适量醋酸溶液,加入少量醋酸钠固体,此时溶液中C(H+)与C(CH3COOH)的比值
(2)醋酸钠水解的离子方程式为
(3)0.5mol?L-1醋酸钠溶液pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠的比值)为a;1mol?L-1醋酸钠溶液pH为n,水解的程度为b,则m与n的关系为
(4)将等体积等浓度的醋酸和氢氧化钠溶液混合后,所得溶液中离子浓度由大到小的顺序是
(5)若醋酸和氢氧化钠溶液混合后pH<7,则c(Na+)
(6)若由pH=3的HA溶液V1mL与pH=11的NaOH溶液V2 mL.混合而得,则下列说法不正确的是
A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7mol?L-1
B.若V1=V2,反应后溶液pH一定等于7
C.若反应后溶液呈酸性,则V1一定大于V2
D.若反应后溶液呈碱性,则V1一定小于V2
(7)在某溶液中含Mg2+、Cd2+、Zn2+三种离子的浓度均为0.01mol?L-1.向其中加入固体醋酸钠后测得溶液的C(OH-)为2.2×10-5mol?L-1,(不考虑溶液体积变化)以上三种金属离子中
(KSP[Mg(OH)2]=1.8×10-11、KSP[Zn(OH)2]=1.2×10-17、KSP[Cd(OH)2]=2.5×10-14)
(8)取10mL 0.5mol?L-1盐酸溶液,加水稀释到500mL,则该溶液中由水电离出的c(H+)=
查看习题详情和答案>>
(1)取适量醋酸溶液,加入少量醋酸钠固体,此时溶液中C(H+)与C(CH3COOH)的比值
减小
减小
(填“增大”或“减小”或“不变”)(2)醋酸钠水解的离子方程式为
CH3COO-+H2O?CH3COOH+OH-;
CH3COO-+H2O?CH3COOH+OH-;
.当升高温度时,C(OH-)将增大
增大
(填“增大”“减小”“不变”);(3)0.5mol?L-1醋酸钠溶液pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠的比值)为a;1mol?L-1醋酸钠溶液pH为n,水解的程度为b,则m与n的关系为
小于
小于
,a与b的关系为大于
大于
(填“大于”“小于”“等于”);(4)将等体积等浓度的醋酸和氢氧化钠溶液混合后,所得溶液中离子浓度由大到小的顺序是
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
.(5)若醋酸和氢氧化钠溶液混合后pH<7,则c(Na+)
小于
小于
c(CH3COO-)(填“大于”、“小于”或“等于”),(6)若由pH=3的HA溶液V1mL与pH=11的NaOH溶液V2 mL.混合而得,则下列说法不正确的是
BC
BC
.A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7mol?L-1
B.若V1=V2,反应后溶液pH一定等于7
C.若反应后溶液呈酸性,则V1一定大于V2
D.若反应后溶液呈碱性,则V1一定小于V2
(7)在某溶液中含Mg2+、Cd2+、Zn2+三种离子的浓度均为0.01mol?L-1.向其中加入固体醋酸钠后测得溶液的C(OH-)为2.2×10-5mol?L-1,(不考虑溶液体积变化)以上三种金属离子中
Cd2+、Zn2+
Cd2+、Zn2+
能生成沉淀,原因是[OH-]=2.2×10-5mol?L-1 、[M2+][OH-]2=5×10-12(mol?L-1)3、5×10-12小于KSP[Mg(OH)2]=1.8×10-11 ,5×10-12大于KSP[Zn(OH)2]=1.2×10-17 ,5×10-12大于KSP[Cd(OH)2]=2.5×10-14.
[OH-]=2.2×10-5mol?L-1 、[M2+][OH-]2=5×10-12(mol?L-1)3、5×10-12小于KSP[Mg(OH)2]=1.8×10-11 ,5×10-12大于KSP[Zn(OH)2]=1.2×10-17 ,5×10-12大于KSP[Cd(OH)2]=2.5×10-14.
(KSP[Mg(OH)2]=1.8×10-11、KSP[Zn(OH)2]=1.2×10-17、KSP[Cd(OH)2]=2.5×10-14)
(8)取10mL 0.5mol?L-1盐酸溶液,加水稀释到500mL,则该溶液中由水电离出的c(H+)=
1×10-12
1×10-12
. (2010?潍坊一模)铁元素及其化合物与人类的生产生活息息相关,
(2010?潍坊一模)铁元素及其化合物与人类的生产生活息息相关,试回答下列问题:
(1)电子工业常用30%,的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板,写出该反应的离子方程式
2Fe3++Cu=2Fe2++Cu2+
2Fe3++Cu=2Fe2++Cu2+
.(2)高炉炼铁过程中会发生反应:FeO(s)+CO(g)?Fe(s)+CO2(g).
已知:Fe(s)+
| 1 | 2 |
C(s)+O2(g)═CO2(g)△H=-393.5kJ?mol-1
2C(s)+O2(g)═2CO(g)△H=-22lkJ?mol-1
则:①FeO(s)+CO(g)?Fe(s)+CO2(g)△H=
一1lkJ?mol-1
一1lkJ?mol-1
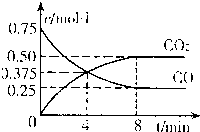
.②一定温度下,向某密闭容器中加入足量FeO,并充入一定量的CO气体,反应过程中CO和CO2的浓度与时间的关系如图所示
则从开始至达到平衡过程中,v(CO)=
0.625mol?L-1?min-1
0.625mol?L-1?min-1
;该温度下,FeO(s)+CO(g)?Fe(s)+CO2(g)的化学平衡常数K=2
2
.(3)铁红是一种红色颜料,其成份是Fe2O3.将一定量的铁红溶于160mL 5mol?L-1盐酸中,再加入一定量铁粉恰好完全溶解,收集到气体2.24L(标准状况),经检测,溶液中无Fe3+,则参加反应的铁粉的质量为
11.2g
11.2g
.某同学探究同周期元素性质的递变规律,并讨论影响化学反应速率的因素.选用的试剂如下:镁条、铝条、铝粉、钠、新制Na2S溶液、新制氯水、0.5mol?L-1盐酸、3mol?L-1盐酸、酚酞试液;其设计的实验方案及部分实验现象如下表:
请回答下列问题:
(1)实验①中可以说明该反应是放热反应的现象是
(2)由实验②可得出决定化学反应快慢的主要因素是
(3)实验③的现象是产生浅黄色沉淀,离子方程式为
由实验③可以得出非金属性氯
(4)实验④中,因为铝粉消失所用的时间短,因此,该同学得出结论:铝比镁易失电子,该结论是否正确?
查看习题详情和答案>>
| 实验步骤 | 实验现象 |
| ①将一小块金属钠投入滴有酚酞试液的冷水中 | 钠块浮在水面上,熔化成闪亮的小球,做不定向移动,随之消失,溶液变红色 |
| ②将表面积大致相同的镁条和铝条(均已用砂纸打磨过)分别投入足量的相同体积0.5mol?L-1盐酸中 | 镁条剧烈反应,迅速产生大量的无色气体,而铝条反应不十分剧烈,产生无色气体,镁条消失比铝条快 |
| ③将新制氯水滴加到新制的Na2S溶液中 | |
| ④将相同质量的镁条(已用砂纸打磨过)和铝粉分别投入到足量的相同体积的0.5mol?L-1盐酸和3mol?L-1盐酸中 | 剧烈反应产生气体,但铝粉消失比镁条快 |
(1)实验①中可以说明该反应是放热反应的现象是
熔化成闪亮的小球
熔化成闪亮的小球
(2)由实验②可得出决定化学反应快慢的主要因素是
反应物的性质
反应物的性质
(3)实验③的现象是产生浅黄色沉淀,离子方程式为
Cl2+S2-=2Cl-+S↓
Cl2+S2-=2Cl-+S↓
由实验③可以得出非金属性氯
强于
强于
硫(填“强于”、“弱于”、“无法比较”).(4)实验④中,因为铝粉消失所用的时间短,因此,该同学得出结论:铝比镁易失电子,该结论是否正确?
否
否
(填“是”或“否”),通过实验④说明要加快化学反应速率可采取的措施可以是增大反应物的浓度
增大反应物的浓度
或增大固体反应物的表面积
增大固体反应物的表面积
.