摘要:下面是某同学在学习硫元素是的学习方案,请完善该同学的学习方案. (1)硫原子的结构,硫是第16号元素,它的原子结 构示意图是 ,从结构可以知道硫元素是一种典型的非金属元素. (2)硫单质的物理性质,硫是一种淡黄色的 体.主要存在于火山喷发口附近或地壳的岩层里.这是硫以游离态形式存在于自然界中.硫元素在自然界中也有以化合态形式存在.如许多金属矿石是含硫化合物.如胆矾 (3)设计如下实验探究硫和含硫化合物的相互转化: (Ⅰ)完成下列各个反应的化学方程式 ①A中在加热时发生的反应 ②C中的反应 (Ⅱ)记录观察到的实验现象 ①B中品红试液由红色变为 .加热后又 . (结论:可以根据该现象用品红试液来证明SO2的存在与否). ②D 中没有观察到什么现象.在实验结束后往D中滴加H2O2后 则可以看到 . ③E 中溶液由紫红色变为无色.反应离子方程式是 2MnO4- + 5SO2 + 2H2O == 2Mn2+ + 5SO42- + 4H+ 反应中SO2是 剂. (Ⅲ)G的作用是吸收尾气.写出反应的离子方程式 (Ⅳ)该同学想利用F溶液来研究硫酸型酸雨在放置一段时间后.其pH变小的理由.请简要的阐明你的理由
网址:http://m.1010jiajiao.com/timu3_id_207485[举报]
某研究性学习小组为测定某含镁3%一5%的铝镁合金(不含其它元素)中镁的质量分数,设计了下列三种不同实验方案进行探究,请根据他们的设计回答有关问题.
【探究一】实验方案:铝镁合金
测定剩余固体质量.
问题讨论:(1)实验中发生反应的化学方程式是 .
(2)若实验中称取5.4g铝镁合金粉末样品,投入VmL2.0mol/L NaOH溶液中,充分反应.则NaOH溶液的体积V≥ mL.
(3)实验中,当铝镁合金充分反应后,在称量剩余固体质量前,还需进行的实验操作按顺序依次为 .
【探究二】实验方案:称量xg铝镁合金粉末,放在如图1所示装置的惰性电热板上,通电使其充分灼烧.
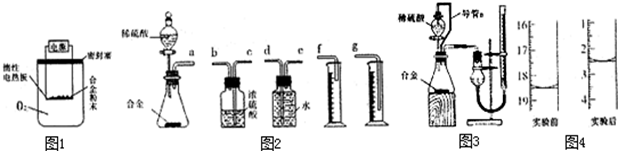
问题讨论:(4)欲计算Mg的质量分数,该实验中还需测定的数据是 .
(5)假设实验中测出该数据为yg,则原铝镁合金粉末中镁的质量分数为 (用含x、y代数式表示).
【探究三】实验方案:铝镁合金
测定生成气体的体积.
问题讨论:(6)同学们拟选用如图2的实验装置完成实验,你认为最简易的装置其连接顺序是:
a接 .(填接口字母,仪器不一定全选.)
(7)同学们仔细分析(6)中连接的实验装置后,又设计了图3所示的实验装置.
①装置中导管a的作用是 .
②实验前后碱式滴定管中液面读数分别如图4,则产生氢气的体积为 mL.
③与上左图装置相比,用(6)中连接的装置进行实验时,容易引起误差的原因是 (任写一点).
查看习题详情和答案>>
【探究一】实验方案:铝镁合金
| NaOH溶液 |
问题讨论:(1)实验中发生反应的化学方程式是
(2)若实验中称取5.4g铝镁合金粉末样品,投入VmL2.0mol/L NaOH溶液中,充分反应.则NaOH溶液的体积V≥
(3)实验中,当铝镁合金充分反应后,在称量剩余固体质量前,还需进行的实验操作按顺序依次为
【探究二】实验方案:称量xg铝镁合金粉末,放在如图1所示装置的惰性电热板上,通电使其充分灼烧.

问题讨论:(4)欲计算Mg的质量分数,该实验中还需测定的数据是
(5)假设实验中测出该数据为yg,则原铝镁合金粉末中镁的质量分数为
【探究三】实验方案:铝镁合金
| 稀硫酸 |
问题讨论:(6)同学们拟选用如图2的实验装置完成实验,你认为最简易的装置其连接顺序是:
a接
(7)同学们仔细分析(6)中连接的实验装置后,又设计了图3所示的实验装置.
①装置中导管a的作用是
②实验前后碱式滴定管中液面读数分别如图4,则产生氢气的体积为
③与上左图装置相比,用(6)中连接的装置进行实验时,容易引起误差的原因是
合金已成为飞机制造、化工生产等行业的重要材料.研究性学习小组的同学,为测定某含镁3%~5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究.填写下列空白.
[实验方案一]将铝镁合金与足量NaOH溶液反应,测定剩余固体质量.实验中发生反应的化学方程式是________
[实验步骤]
(1)称取5.4 g铝镁合金粉末样品,溶于V mL 2.0 mol/L NaOH溶液中,充分反应.则NaOH溶液的体积V≥________.
(2)过滤、洗涤、干燥、称量固体.该步骤中若未洗涤固体,测得镁的质量分数将________(填“偏高”、“偏低”或“无影响”).
[实验方案二]将铝镁合金与足量稀硫酸溶液反应,测定生成气体在通常状况(约20℃,1.01×105 Pa)的体积.
[问题讨论]
(3)同学们拟选用下列实验装置完成实验:
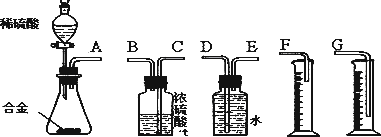
①你认为最简易的装置其连接顺序是(填接口字母,可不填满):
A接( )( )接( )( )接( )
②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶.请你帮助分析原因.________.
③实验结束时,在读取测量实验中生成氢气的体积时,你认为合理的是________.
A.待实验装置冷却后再读数
B.上下移动量筒F,使其中液面与广口瓶中液面相平
C.上下移动量筒G,使其中液面与广口瓶中液面相平
D.视线与凹液面的最低点水平,读取量筒中水的体积
铝镁合金已成为飞机制造、化工生产等行业的重要材料.研究性学习小组的同学,为测定某含镁3%-5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究.填写下列空白.
【方案一】
将铝镁合金与足量NaOH溶液反应,测定剩余固体质量.实验中发生反应的化学方程式是
(1)称取5.4g铝镁合金粉末样品,溶于V mL 2.0mol/L NaOH溶液中.为使其反应完全,则NaOH溶液的体积V≥
(2)过滤、洗涤、干燥、称量固体.该步骤中若未洗涤固体,测得镁的质量分数将
【方案二】
将铝镁合金与足量稀硫酸溶液反应,测定生成气体在通常状况(约20℃,1.01×105Pa)的体积.
(1)同学们拟选用下列实验装置完成实验如图1:
①你认为最简易的装置其连接顺序是:A接
②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶.请你帮助分析原因
③实验结束时,在读取测量实验中生成氢气的体积时,你认为合理的是
A.待实验装置冷却后再读数
B.上下移动量筒F,使其中液面与广口瓶中液面相平
C.上下移动量筒G,使其中液面与广口瓶中液面相平
D.视线与凹液面的最低点水平读取量筒中水的体积
(2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸 滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小.于是他们设计了图2所示的实验装置.
①装置中导管a的作用是
②实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL.则产生氢气的体积为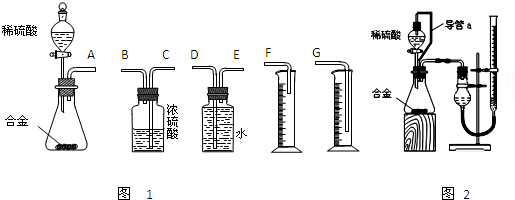
查看习题详情和答案>>
【方案一】
将铝镁合金与足量NaOH溶液反应,测定剩余固体质量.实验中发生反应的化学方程式是
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
.(1)称取5.4g铝镁合金粉末样品,溶于V mL 2.0mol/L NaOH溶液中.为使其反应完全,则NaOH溶液的体积V≥
97mL
97mL
.(2)过滤、洗涤、干燥、称量固体.该步骤中若未洗涤固体,测得镁的质量分数将
偏高
偏高
(填“偏高”、“偏低”或“无影响”).【方案二】
将铝镁合金与足量稀硫酸溶液反应,测定生成气体在通常状况(约20℃,1.01×105Pa)的体积.
(1)同学们拟选用下列实验装置完成实验如图1:
①你认为最简易的装置其连接顺序是:A接
E
E
接D
D
接G
G
(填接口字母,可不填满.)②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶.请你帮助分析原因
镁、铝与稀硫酸反应放热且生成气体,使锥形瓶中气体压强变大
镁、铝与稀硫酸反应放热且生成气体,使锥形瓶中气体压强变大
.③实验结束时,在读取测量实验中生成氢气的体积时,你认为合理的是
ACD
ACD
.A.待实验装置冷却后再读数
B.上下移动量筒F,使其中液面与广口瓶中液面相平
C.上下移动量筒G,使其中液面与广口瓶中液面相平
D.视线与凹液面的最低点水平读取量筒中水的体积
(2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸 滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小.于是他们设计了图2所示的实验装置.
①装置中导管a的作用是
保持分液漏斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗活塞时稀硫酸能顺利滴下,滴入锥形瓶的稀硫酸体积等于进入分液漏斗的气体体积,从而消除由于加入稀硫酸引起的氢气体积误差
保持分液漏斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗活塞时稀硫酸能顺利滴下,滴入锥形瓶的稀硫酸体积等于进入分液漏斗的气体体积,从而消除由于加入稀硫酸引起的氢气体积误差
.②实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL.则产生氢气的体积为
V1-V2
V1-V2
mL.
铝镁合金已成为飞机制造、化工生产等行业的重要材料.研究性学习小组的同学,为测定某含镁3%-5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究.填写下列空白.
【方案一】
将铝镁合金与足量NaOH溶液反应,测定剩余固体质量.实验中发生反应的化学方程式是______.
(1)称取5.4g铝镁合金粉末样品,溶于V mL 2.0mol/L NaOH溶液中.为使其反应完全,则NaOH溶液的体积V≥______.
(2)过滤、洗涤、干燥、称量固体.该步骤中若未洗涤固体,测得镁的质量分数将______(填“偏高”、“偏低”或“无影响”).
【方案二】
将铝镁合金与足量稀硫酸溶液反应,测定生成气体在通常状况(约20℃,1.01×105Pa)的体积.
(1)同学们拟选用下列实验装置完成实验如图1:
①你认为最简易的装置其连接顺序是:A接______接______接______(填接口字母,可不填满.)
②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶.请你帮助分析原因______.
③实验结束时,在读取测量实验中生成氢气的体积时,你认为合理的是______.
A.待实验装置冷却后再读数
B.上下移动量筒F,使其中液面与广口瓶中液面相平
C.上下移动量筒G,使其中液面与广口瓶中液面相平
D.视线与凹液面的最低点水平读取量筒中水的体积
(2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸 滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小.于是他们设计了图2所示的实验装置.
①装置中导管a的作用是______.
②实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL.则产生氢气的体积为______mL.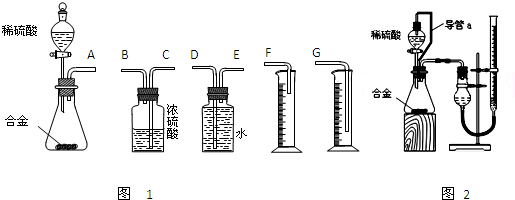
查看习题详情和答案>>
铝镁合金已成为飞机制造、化工生产等行业的重要材料.研究性学习小组的同学,为测定某含镁3%-5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究.填写下列空白.
【方案一】
将铝镁合金与足量NaOH溶液反应,测定剩余固体质量.实验中发生反应的化学方程式是______.
(1)称取5.4g铝镁合金粉末样品,溶于V mL 2.0mol/L NaOH溶液中.为使其反应完全,则NaOH溶液的体积V≥______.
(2)过滤、洗涤、干燥、称量固体.该步骤中若未洗涤固体,测得镁的质量分数将______(填“偏高”、“偏低”或“无影响”).
【方案二】
将铝镁合金与足量稀硫酸溶液反应,测定生成气体在通常状况(约20℃,1.01×105Pa)的体积.
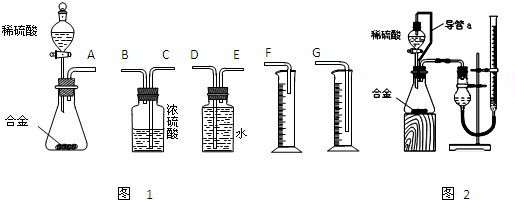
(1)同学们拟选用下列实验装置完成实验如图1:
①你认为最简易的装置其连接顺序是:A接______接______接______(填接口字母,可不填满.)
②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶.请你帮助分析原因______.
③实验结束时,在读取测量实验中生成氢气的体积时,你认为合理的是______.
A.待实验装置冷却后再读数
B.上下移动量筒F,使其中液面与广口瓶中液面相平
C.上下移动量筒G,使其中液面与广口瓶中液面相平
D.视线与凹液面的最低点水平读取量筒中水的体积
(2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸 滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小.于是他们设计了图2所示的实验装置.
①装置中导管a的作用是______.
②实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL.则产生氢气的体积为______mL.
查看习题详情和答案>>
【方案一】
将铝镁合金与足量NaOH溶液反应,测定剩余固体质量.实验中发生反应的化学方程式是______.
(1)称取5.4g铝镁合金粉末样品,溶于V mL 2.0mol/L NaOH溶液中.为使其反应完全,则NaOH溶液的体积V≥______.
(2)过滤、洗涤、干燥、称量固体.该步骤中若未洗涤固体,测得镁的质量分数将______(填“偏高”、“偏低”或“无影响”).
【方案二】
将铝镁合金与足量稀硫酸溶液反应,测定生成气体在通常状况(约20℃,1.01×105Pa)的体积.
(1)同学们拟选用下列实验装置完成实验如图1:
①你认为最简易的装置其连接顺序是:A接______接______接______(填接口字母,可不填满.)
②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶.请你帮助分析原因______.
③实验结束时,在读取测量实验中生成氢气的体积时,你认为合理的是______.
A.待实验装置冷却后再读数
B.上下移动量筒F,使其中液面与广口瓶中液面相平
C.上下移动量筒G,使其中液面与广口瓶中液面相平
D.视线与凹液面的最低点水平读取量筒中水的体积
(2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸 滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小.于是他们设计了图2所示的实验装置.
①装置中导管a的作用是______.
②实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL.则产生氢气的体积为______mL.
