网址:http://m.1010jiajiao.com/timu3_id_207288[举报]
 金属及其化合物在人类生活、生产中发挥着重要的作用.
金属及其化合物在人类生活、生产中发挥着重要的作用.(1)将一小块金属钠投入盛有水的烧杯中,发生反应的化学方程式为:
可观察到的实验现象是
a.钠沉到水底 b.钠熔成小球 c.钠球四处游动 d.溶液呈红色
(2)在钠、铝、铁三种金属元素中,其所形成氧化物种类最多的是
氧化物中适宜做耐火材料的是
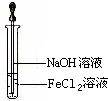
(3)取少量FeCl2溶液,按如图所示的操作,使其跟NaOH溶液反应.可观察到的现象是
(4)向盛有氯化铁、氯化亚铁、氯化铜混合溶液的烧杯中加入铁粉和铜粉,反应结束后,下列结果不可能出现的是
A.有铜无铁B.有铁无铜 C.铁、铜都有 D.铁、铜都无.
Ⅰ.A、B、C、D均是前四周期元素组成的常见不同单质或化合物。它们之间有如下转化关系:

(1)若A、B、C、D都是氧化物,且A为光导纤维的主要材料,试写出③化学反应方程式: _______???????????? __________
(2)若A、B、C、D均含有同一种常见金属元素,B是黑色磁性固体,D是一种红褐色沉淀,反应②在常见稀酸中进行,C是该反应中生成的唯一盐,反应②的离子方程式是________ _______, C盐水溶液PH______7 (填“>”“<”“ =”)。
(3)若A、B、C、D均含有同一种短周期的金属元素,且B和D在溶液中反应生成沉淀C,则下列判断正确的是______(填“小写”字母)。
a.A可能是一种耐火材料;
b.B的溶液一定呈碱性;
c.C 一定既溶于盐酸又溶于苛性钠溶液;?
若A为金属单质,则用1molA金属制备C,最少需_____mol HCl和_____mol NaOH。
Ⅱ.汽车安全气囊是行车安全的重要保障。当车辆发生碰撞的瞬间,安全装置通电点火使其中的固体粉末释放出大量的氮气形成气囊,从而保护司机及乘客免受伤害。为研究安全气囊工作的化学原理,取安全装置中的固体粉末进行实验。经组成分析,确定该粉末仅含有Na、Fe、N、O四种元素。水溶性实验表明,固体粉末部分溶解。经检测,可溶物为化合物甲,不溶物为红棕色固体,可溶于盐酸。取13.0g化合物甲(摩尔质量为65g/ mol),加热使其完全分解,生成氮气和单质乙,生成的氮气折合成标准状况下的体积为6.72L。单质乙在高温隔绝空气的条件下与不溶物红棕色粉末反应生成一种碱性氧化物丙和另一种单质。化合物丙与空气接触可转化为可溶性盐。
请回答下列问题:
(1)甲受热分解的化学方程式为??????????????????? 。
(2)丙的电子式为??????????? 。
(3)以下物质中,有可能作为安全气囊中红棕色粉末替代品的是??????????? 。
A.KCl??????????? B.KOH?????????? C.Na2S????????????? D.CuO
查看习题详情和答案>>
葡萄糖酸锌[(C6H11O6O)2Zn]是一种营养锌强化剂,对婴儿及青少年的智力和身体发育有重要作用。工业上通过如下两步制备:
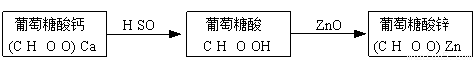
(1)步骤一:充分反应后,过滤除去CaSO4沉淀。设计一个简单的实验,检验产物葡萄糖酸溶液中是否含有SO42—:????? 。
(2)步骤二:将葡萄糖酸溶液与ZnO混合,使其充分反应后,继续加入葡萄糖酸溶液至pH为5.8,其目的是????? ,下列物质可替代ZnO的是????? (填字母)。
a.NH3·H2O??????? b. Zn(OH)2????????? c.NaOH???????? d.ZnSO4
(3)将最后所得溶液浓缩至原来体积的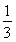 ,加入适量无水乙醇,放置8h以上,经结晶、分离、干燥获得葡萄糖酸锌晶体。分离过程中加入无水乙醇的目的是????? 。
,加入适量无水乙醇,放置8h以上,经结晶、分离、干燥获得葡萄糖酸锌晶体。分离过程中加入无水乙醇的目的是????? 。
(4)下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1. 1 | 3. 2 |
Fe2+ | 5. 8 | 8. 8 |
Cu2+ | 5. 2 | 6. 4 |
某研究性学习小组欲用粗制硫酸锌溶液(其中含有Fe2+、Cu2+等)制备出活性ZnO,然后再合成葡萄糖酸锌。实验室制备活性ZnO的步骤如下:
①取样,加入适量的KMnO4溶液,微热,调节溶液pH至????? (填写范围),除去溶液中Fe元素。
②加入????? ,过滤,向滤渣中加入适量稀硫酸,继续过滤,将两次滤液合并得较高纯度的硫酸锌溶液。
③将纯碱慢慢加入上述硫酸锌溶液中,得碱式碳酸锌[其化学式为Zn2(OH)2CO3],同时有无色气体产生。写出该反应的离子方程式:????? 。
④过滤、洗涤,将沉淀灼烧得活性氧化锌。其中灼烧需要的主要仪器有:酒精灯、玻璃棒、三脚架、泥三角、????? 等。
查看习题详情和答案>>
Ⅰ.A、B、C、D均是前四周期元素组成的常见不同单质或化合物。它们之间有如下转化关系:
(1)若A、B、C、D都是氧化物,且A为光导纤维的主要材料,试写出③化学反应方程式: _______ __________
(2)若A、B、C、D均含有同一种常见金属元素,B是黑色磁性固体,D是一种红褐色沉淀,反应②在常见稀酸中进行,C是该反应中生成的唯一盐,反应②的离子方程式是________ _______, C盐水溶液PH______7 (填“>”“<”“ =”)。
(3)若A、B、C、D均含有同一种短周期的金属元素,且B和D在溶液中反应生成沉淀C,则下列判断正确的是______(填“小写”字母)。
a.A可能是一种耐火材料;
b.B的溶液一定呈碱性;
c.C 一定既溶于盐酸又溶于苛性钠溶液;
若A为金属单质,则用1molA金属制备C,最少需_____mol HCl和_____mol NaOH。
Ⅱ.汽车安全气囊是行车安全的重要保障。当车辆发生碰撞的瞬间,安全装置通电点火使其中的固体粉末释放出大量的氮气形成气囊,从而保护司机及乘客免受伤害。为研究安全气囊工作的化学原理,取安全装置中的固体粉末进行实验。经组成分析,确定该粉末仅含有Na、Fe、N、O四种元素。水溶性实验表明,固体粉末部分溶解。经检测,可溶物为化合物甲,不溶物为红棕色固体,可溶于盐酸。取13.0g化合物甲(摩尔质量为65g/ mol),加热使其完全分解,生成氮气和单质乙,生成的氮气折合成标准状况下的体积为6.72L。单质乙在高温隔绝空气的条件下与不溶物红棕色粉末反应生成一种碱性氧化物丙和另一种单质。化合物丙与空气接触可转化为可溶性盐。
请回答下列问题:
(1)甲受热分解的化学方程式为 。
(2)丙的电子式为 。
(3)以下物质中,有可能作为安全气囊中红棕色粉末替代品的是 。
A.KCl B.KOH C.Na2S D.CuO
葡萄糖酸锌[(C6H11O6O)2Zn]是一种营养锌强化剂,对婴儿及青少年的智力和身体发育有重要作用。工业上通过如下两步制备:
(1)步骤一:充分反应后,过滤除去CaSO4沉淀。设计一个简单的实验,检验产物葡萄糖酸溶液中是否含有SO42—: 。
(2)步骤二:将葡萄糖酸溶液与ZnO混合,使其充分反应后,继续加入葡萄糖酸溶液至pH为5.8,其目的是 ,下列物质可替代ZnO的是 (填字母)。
a.NH3·H2O b.Zn(OH)2 c.NaOH d.ZnSO4
(3)将最后所得溶液浓缩至原来体积的 ,加入适量无水乙醇,放置8h以上,经结晶、分离、干燥获得葡萄糖酸锌晶体。分离过程中加入无水乙醇的目的是 。
,加入适量无水乙醇,放置8h以上,经结晶、分离、干燥获得葡萄糖酸锌晶体。分离过程中加入无水乙醇的目的是 。
(4)下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1. 1 | 3. 2 |
| Fe2+ | 5. 8 | 8. 8 |
| Cu2+ | 5. 2 | 6. 4 |
某研究性学习小组欲用粗制硫酸锌溶液(其中含有Fe2+、Cu2+等)制备出活性ZnO,然后再合成葡萄糖酸锌。实验室制备活性ZnO的步骤如下:
①取样,加入适量的KMnO4溶液,微热,调节溶液pH至 (填写范围),除去溶液中Fe元素。
②加入 ,过滤,向滤渣中加入适量稀硫酸,继续过滤,将两次滤液合并得较高纯度的硫酸锌溶液。
③将纯碱慢慢加入上述硫酸锌溶液中,得碱式碳酸锌[其化学式为Zn2(OH)2CO3],同时有无色气体产生。写出该反应的离子方程式: 。
④过滤、洗涤,将沉淀灼烧得活性氧化锌。其中灼烧需要的主要仪器有:酒精灯、玻璃棒、三脚架、泥三角、 等。 查看习题详情和答案>>