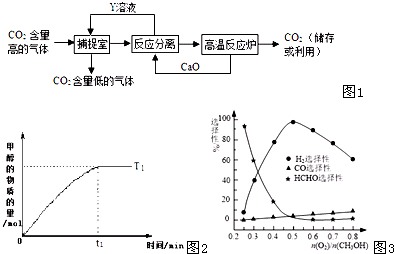
网址:http://m.1010jiajiao.com/timu3_id_207149[举报]

(1)下列有关该捕捉过程的叙述正确的有______
A.捕捉到的CO2可制备其它化工产品,减少了温室气体排放
B.“反应分离室”中的反应要吸收大量热
C.整个过程中,只有一种物质可循环利用
D.能耗大是该捕捉技术的一大缺点
(2)一定条件光催化分解CO2发生反应:2CO2(g)2CO(g)+O2(g),该反应的△S______0、△H______0(填“>”、“<”、“=”)
(3)以CO2与H2为原料还可合成液体燃料甲醇(CH3OH),其反应的化学方程为:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H<0.
①将1mol CO2和3mol H2充入2L的密闭容器中发生上述反应,下列说法正确的是______.
A.若保持恒温,则达到平衡时反应速率3V正(H2)=V逆(CH3OH)
B.若为绝热容器,当容器内混合气体的温度恒定时,该反应已达平衡状态
C.从反应开始至达到平衡的过程中,CO和H2的转化率均相等
D.保持温度不变,当反应已达平衡时,若向容器中再充入1mol CO2和3mol H2,当达到新平衡时,n(CH3OH):n(H2)将升高
②若其他条件不变,在恒容、温度T1时甲醇的物质的量与时间的图象如图2所示.请补充完成温度为T2(化学平衡常数K(T1)>K(T2))时甲醇的物质的量随时间变化的示意图.
③在一个有催化剂的固定容积的容器中加入1mol CO2,3mol H2,在一定温度下充分反应达到平衡,放出热量为a kJ.若在原来的容器中只加入1mol CH3OH(g)和1mol H2O(g),在相同温度下充分反应,达到平衡时吸收热量为b kJ.则反应CO2(g)+3H2(g)═CH3OH(g)+H2O(g) 的△H=______kJ?mol-1 (用含a、b的代数式表示).
(4)在一定温度下以Ag/CeO2-ZnO为催化剂时甲醇与氧气的比例对反应的选择性(选择性越大,表示生成的该物质越多)影响关系如图3所示.则当n(O2)/n(CH3OH)=0.25时,CH3OH与O2发生的主要反应方程式为______ 查看习题详情和答案>>
(1)下列有关该捕捉过程的叙述正确的有
A.捕捉到的CO2可制备其它化工产品,减少了温室气体排放
B.“反应分离室”中的反应要吸收大量热
C.整个过程中,只有一种物质可循环利用
D.能耗大是该捕捉技术的一大缺点
(2)一定条件光催化分解CO2发生反应:2CO2(g)2CO(g)+O2(g),该反应的△S
(3)以CO2与H2为原料还可合成液体燃料甲醇(CH3OH),其反应的化学方程为:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H<0.
①将1mol CO2和3mol H2充入2L的密闭容器中发生上述反应,下列说法正确的是
A.若保持恒温,则达到平衡时反应速率3V正(H2)=V逆(CH3OH)
B.若为绝热容器,当容器内混合气体的温度恒定时,该反应已达平衡状态
C.从反应开始至达到平衡的过程中,CO和H2的转化率均相等
D.保持温度不变,当反应已达平衡时,若向容器中再充入1mol CO2和3mol H2,当达到新平衡时,n(CH3OH):n(H2)将升高
②若其他条件不变,在恒容、温度T1时甲醇的物质的量与时间的图象如图2所示.请补充完成温度为T2(化学平衡常数K(T1)>K(T2))时甲醇的物质的量随时间变化的示意图.
③在一个有催化剂的固定容积的容器中加入1mol CO2,3mol H2,在一定温度下充分反应达到平衡,放出热量为a kJ.若在原来的容器中只加入1mol CH3OH(g)和1mol H2O(g),在相同温度下充分反应,达到平衡时吸收热量为b kJ.则反应CO2(g)+3H2(g)═CH3OH(g)+H2O(g) 的△H=
(4)在一定温度下以Ag/CeO2-ZnO为催化剂时甲醇与氧气的比例对反应的选择性(选择性越大,表示生成的该物质越多)影响关系如图3所示.则当n(O2)/n(CH3OH)=0.25时,CH3OH与O2发生的主要反应方程式为
| 催化剂 |
| △ |
| 催化剂 |
| △ |
(1)完成并配平离子反应方程式:
(2)请完成相应的实验步骤:
步骤1:称取35.60g草酸三氢钾试样,加水溶解,配成250mL溶液.
步骤2:用移液管量取两份此溶液各25.00mL,分别置于两个锥形瓶中.
步骤3:第1份溶液加硫酸酸化后,用0.1000mol?L-1的高锰酸钾溶液滴定,至滴定终点消耗高锰酸钾溶液12.00mL.
步骤4:在第2份溶液中
(3)根据(2)中的实验步骤回答:
①步骤1用到的实验仪器有:电子天平、药匙、烧杯、玻璃棒、
②如何判断步骤3中的滴定终点?
③3.560g试样中含有还原剂(草酸根)的物质的量共为
(4)热重分析法(TG)是在程序控制温度下,测量物质的质量与温度的关系的一种实验技术.热重分析仪的基本构造由精密天平、程序控温加热炉和记录仪组成;记录仪画出剩余固体质量(m)~炉温(T)曲线,即热重(TG)曲线图.如图为CaC2O4?H2O在N2和O2气氛中的热重曲线.
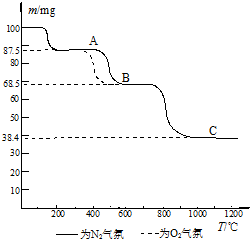
①C点所得固体的化学式为
②CaC2O4?H2O的分解分三个阶段,由图可看出,第二阶段在O2气氛中的反应速率要比在N2气氛中的快,原因是
二甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能。四川是利用天然气生产二甲醚的重要基地之一,四川汶川大地震对该地二甲醚的生产影响较大。
请填写下列空白:
⑴二甲醚可由合成气(CO+H2)在一定条件下制得。用合成气制二甲醚时,还产生了可参与大气循环的无机化合物水或二氧化碳,该反应的化学方程式可能是: 。
⑵乙醚(CH3CH2OCH2CH3)是二甲醚的同系物,既是常见的有机溶剂又是很好的麻醉剂,在汶川大地震救死扶伤的过程中起了一定的作用。写出两种与乙醚相对分子质量相等且元素种类相同,分子中含有两个甲基的非醇类有机物的结构简式 ; 。
⑶以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极构成燃料电池。该电池的化学反应方程式是: 。
⑷用二甲醚燃料电池为电源,用铂电极电解KCl和CuSO4的混合溶液,当电路中通过0.3mol电子的电量时,阴阳两极都产生2.8L的气体(标准状况),若电解后溶液体积为1L,则
①试判断阴极气体的成分。
②通过计算求阳极气体的成分及物质的量。
查看习题详情和答案>>(1)某芳族化物A由碳、氢、氧三种元素组成,其蒸气密度是相同条件下H2密度的69倍。已知0.1 molA在氧气中完全燃烧得30.8gCO2和0.3mol H2O, 则A的分子式是____________。
A可以与NaHCO3溶液反应、其苯环上有两个邻位的取代基,则A中含氧官能团的名称是
已知:![]()
(2)A可以与![]() 反应制得有机物B(分子式为C9H9O4,遇FeCl3溶液不能显色),该反应的化学方程式是____________________________________
反应制得有机物B(分子式为C9H9O4,遇FeCl3溶液不能显色),该反应的化学方程式是____________________________________
(3)已知下列下列信息。分子式为C3H4的烃可以发生下图转化:
![]()
![]()
其中E、F均呈酸性。F可以与有机物B和乙二醇共同发生反应得到有机物G,由G通过加聚反应可以进一步合成分子式为(C15H?15O6)2的药物H。
①写出F的同分异构体结构简式,且满足a)属于链状酯类、b)分子中每个碳原子上都连有氢原子___________________________________________
②C→D的化学方程式是_________________________________
③H的结构简式是_______________________________
查看习题详情和答案>>