摘要: B 2Al+2OH-+2H2O=2AlO2-+3H2↑ (2) 3Fe+ 4H2O = Fe3O4 + 4H2 黑色固体变为红色 . 除去H2中的水蒸气 (3)取待测样滴加KSCN.看是否呈现血红色 (4)在装置最后面加上:点燃的酒精灯 (5)① 2Fe3++Cl2=2Fe2++2Cl- ②蒸发浓缩.冷却结晶.过滤 ③ B 出现白色沉淀.马上变成灰绿色.最终变成红褐色 FeCl2 +2NaOH=Fe(OH)2↓ +2 NaCl .4 Fe(OH)2 +O2+2H2O=4 Fe(OH)3
网址:http://m.1010jiajiao.com/timu3_id_207125[举报]
现有A─E五种元素,其中C、D、E三种是短周期元素.A、B的单质均为生活中常见的金属,A的两种黑色氧化物(其中一种有磁性)的相对分子质量相差160,B的相对原子质量比A大8.C是金属元素,其原子的M层有一个未成对的p电子;D元素的主族序数是其所在周期序数的3倍;E的某种原子的原子核内没有中子.
(1)请写出A在元素周期表中的位置
(2)①写出C单质与强碱溶液反应的离子方程式是
②在高温条件下,将D、E组成的气态化合物与A 的粉末充分反应,生成8g E的单质和相应的固态化合物时,放出a kJ 热量,此反应的热化学方程式是
③A的某种氯化物溶液呈黄色,它与B的单质的反应工业上常用于腐蚀电路板,请写出反应的离子方程式
查看习题详情和答案>>
(1)请写出A在元素周期表中的位置
第四周期第ⅤⅢ族
第四周期第ⅤⅢ族
;写出C的核外电子排布式1s22s22p63s23p1
1s22s22p63s23p1
;D和E按1:1的原子个数比形成的化合物中含有的化学键为极性键和非极性键
极性键和非极性键
(填“极性键”、“非极性键”或“极性键和非极性键”).(2)①写出C单质与强碱溶液反应的离子方程式是
2Al+2H2O+2OH-═2AlO2-+3H2↑
2Al+2H2O+2OH-═2AlO2-+3H2↑
.②在高温条件下,将D、E组成的气态化合物与A 的粉末充分反应,生成8g E的单质和相应的固态化合物时,放出a kJ 热量,此反应的热化学方程式是
3Fe(s)+4H2O(g)
Fe3O4(s)+4H2(g)△H=-akJ/mol
| ||
3Fe(s)+4H2O(g)
Fe3O4(s)+4H2(g)△H=-akJ/mol
.
| ||
③A的某种氯化物溶液呈黄色,它与B的单质的反应工业上常用于腐蚀电路板,请写出反应的离子方程式
Cu+2Fe3+═2Fe2++Cu2+
Cu+2Fe3+═2Fe2++Cu2+
.(2013?资阳模拟)A、B、C、D、E是常见单质,其中A是用量最大、应用最广泛的金属;元素D原子的3p能级上只有1个电子;E是实验室常用的惰性电极材料.G、H、I、J、K、L是常见化合物,其中G在常温下是无色液体,H是黑色固体,I既能溶于盐酸,也能溶于NaOH溶液,J是白色粉末.以上物质相互间的转化关系如图所示:

请回答下列问题:
(1)G分子的中心原子轨道杂化类型为
(2)K分子的立体构型为
(3)A→H+B的反应方程式为:
(4)D能与氢氧化钠溶液反应,请写出该反应的离子方程式
(5)116g H全部转化为A时,转移电子的物质的量为
查看习题详情和答案>>

请回答下列问题:
(1)G分子的中心原子轨道杂化类型为
sp3
sp3
杂化;G的熔沸点比H2S高,原因是分子间存在氢键
分子间存在氢键
.(2)K分子的立体构型为
直线
直线
形;熔沸点K小于J,原因是K为分子晶体,J为离子晶体
K为分子晶体,J为离子晶体
.(3)A→H+B的反应方程式为:
3Fe+4H2O
Fe3O4+4H2
| ||
3Fe+4H2O
Fe3O4+4H2
.
| ||
(4)D能与氢氧化钠溶液反应,请写出该反应的离子方程式
2Al+2OH-+2H2O=2AlO2-+3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑
.(5)116g H全部转化为A时,转移电子的物质的量为
4
4
mol.A、B、C、D是四种常见的单质,A、B为金属,C、D常温下是气体,且D为黄绿色气体.甲、乙、丙为常见的化合物,甲是黑色且具有磁性的物质.它们之间的转化关系如下图所示:
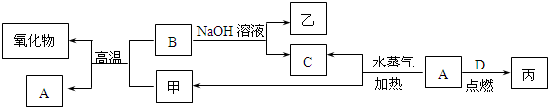
请回答下列问题:
(1)B与甲反应的化学方程式是
(2)常温下,将A或B的单质放入浓硫酸或浓硝酸中,是否溶解?
(3)将丙溶于水配成溶液,检验丙中阳离子的方法是
(4)写出A与水蒸气反应生成C和甲的化学方程式
(5)将A、B两种金属按一定的质量比组成混合物.
①取一定质量的该混合物,向其中加入足量的NaOH溶液,生成气体的体积在标准状况下为n L,B与NaOH溶液反应的离子方程式是
mol(用含字母的分数式表示).
②另取相同质量的该混合物,向其中加入足量的稀硫酸,固体全部溶解,生成气体的体积在标准状况下为m L,该反应中转移电子的物质的量为
mol,混合物中A的质量为
×56
×56g(用含字母的分数式表示).
③向②所得的溶液中加入过量的氢氧化钠溶液,充分搅拌,将产生的沉淀过滤出来,经洗涤、干燥、灼烧后得到一种固体,经称量发现该固体的质量和原混合物的质量恰好相等,则原混合物中铝的质量分数为
查看习题详情和答案>>

请回答下列问题:
(1)B与甲反应的化学方程式是
3Fe3O4+8Al
9Fe+4Al2O3
| ||
3Fe3O4+8Al
9Fe+4Al2O3
.
| ||
(2)常温下,将A或B的单质放入浓硫酸或浓硝酸中,是否溶解?
否
否
(填“是”或“否”).(3)将丙溶于水配成溶液,检验丙中阳离子的方法是
取少量丙的溶液于试管中,滴加KSCN溶液,若溶液变红,说明丙中存在Fe3+
取少量丙的溶液于试管中,滴加KSCN溶液,若溶液变红,说明丙中存在Fe3+
.(4)写出A与水蒸气反应生成C和甲的化学方程式
3Fe+4H2O(g)
Fe3O4+4H2
| ||
3Fe+4H2O(g)
Fe3O4+4H2
.
| ||
(5)将A、B两种金属按一定的质量比组成混合物.
①取一定质量的该混合物,向其中加入足量的NaOH溶液,生成气体的体积在标准状况下为n L,B与NaOH溶液反应的离子方程式是
2Al+2OH-+2H2O=2AlO2-+3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑
,混合物中B的物质的量为| n |
| 33.6 |
| n |
| 33.6 |
②另取相同质量的该混合物,向其中加入足量的稀硫酸,固体全部溶解,生成气体的体积在标准状况下为m L,该反应中转移电子的物质的量为
| m |
| 11.2 |
| m |
| 11.2 |
| m-n |
| 22.4 |
| m-n |
| 22.4 |
③向②所得的溶液中加入过量的氢氧化钠溶液,充分搅拌,将产生的沉淀过滤出来,经洗涤、干燥、灼烧后得到一种固体,经称量发现该固体的质量和原混合物的质量恰好相等,则原混合物中铝的质量分数为
30%
30%
.