网址:http://m.1010jiajiao.com/timu3_id_206816[举报]
(1)人体中经常进行Fe2+![]() Fe3+的转化,在过程A中,Fe2+作___________剂,过程B中Fe3+被___________。
Fe3+的转化,在过程A中,Fe2+作___________剂,过程B中Fe3+被___________。
(2)Vc使Fe3+转化为Fe2+,Vc在这一过程中作___________,具有___________性。
查看习题详情和答案>>一个体重50 kg的健康人,体内约含有2 g铁,这2 g铁在人体内不是以单质的形式存在,而是以Fe2+和Fe3+的形式存在.正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁.服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收.
(1)在人体中进行Fe2+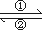 Fe3+的转化时,②中的Fe3+作________剂;
Fe3+的转化时,②中的Fe3+作________剂;
(2)“服用维生素C,可使食物中的Fe3+ 还原成Fe2+”这句话指出,维生素C在这一反应中作________剂,具有________性.
(3)市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸的作用下转化成亚铁盐,此反应的离子方程式为________.
| |||||||||||||||