摘要:24.在KClO3 + 6HCl = KCl +3Cl2↑ + 3H2O反应中.HCl做 剂. 氧化产物与还原产物的物质的量之比是 .当反应中有3mol电子转移时.可产生氯气 mol. 25.某学生课外活动小组利用右图所示装置分别做如下实验: (1)在试管中注入某红色溶液.加热试管.溶液颜色逐渐变浅.冷却后恢复红色.则原溶液可能是 溶液,加热时溶液由红色逐渐变浅的原因是: . (2)在试管中注入某无色溶液.加热试管.溶液变为红色.冷却后恢复无色.则此溶液可能是 溶液,加热时溶液由无色变为红色的原因是 .
网址:http://m.1010jiajiao.com/timu3_id_206420[举报]
实验填空题:实验室现要制取一瓶纯净干燥的氯气.现有如图仪器和药品可供使用:
(1)实验室制取氯气的原理: ;其中HCl所表现的性质是 .
(2)连接上述仪器的正确顺序是(填各接口处的字母) 接 , 接 , 接 , 接 .
(3)在以上装置中,分别盛装了一些溶液,试说明所装溶液的作用.饱和食盐水的作用是 ;浓硫酸的作用是 ;氢氧化钠的作用是 .
(4)盛装NaOH溶液的试剂瓶中发生的化学反应为: .
查看习题详情和答案>>

(1)实验室制取氯气的原理:
(2)连接上述仪器的正确顺序是(填各接口处的字母)
(3)在以上装置中,分别盛装了一些溶液,试说明所装溶液的作用.饱和食盐水的作用是
(4)盛装NaOH溶液的试剂瓶中发生的化学反应为:
 填空题
填空题(1)列叙述正确的是
BCFG
BCFG
(填写序号)A.不慎把苯酚溶液沾到了皮肤上,应立即用大量水冲洗.
B.乙醛和新制氢氧化铜的反应实验要有明显现象,必须在强碱性条件下加热煮沸.
C.只有碳、氢两种元素组成的有机化合物称为烃.
D.甲、乙两种有机物具有相同的相对分子质量和不同结构,则甲和乙一定是同分异构体.
E.乙烯、乙醇和乙醛均能发生加成反应.
F.浓溴水滴入苯酚溶液中能产生2,4,6-三溴苯酚的白色沉淀.
G.溴的苯溶液中加少量铁粉后会剧烈反应,并放出大量的热,该现象能说明苯和溴的取代反应是放热反应.
(2)乙醇分子中各化学键如图所示,对乙醇在各种反应中应断裂的键说明正确的是:(填写序号)
①和金属钠作用时,断裂
①
①
;②和浓硫酸共热至170℃时,断裂
②⑤
②⑤
;③在铜催化下和氧气反应时,断裂
①④
①④
;④与氢卤酸反应时,断裂
②
②
.
填空题
(1)将复杂硅酸盐改写成氧化物形式:KAlSi3O8: .
(2)有一包白色粉末可能由K2SO4、NaHCO3、BaCl2、FeCl3、KCl五种物质中的某几种组成,现进行如下实验:
①将白色粉末加水溶解,得无色溶液.
②向①中所得的无色溶液中加入NaOH溶液,观察到有白色沉淀A生成,过滤后,向滤液中滴加硝酸酸化的AgNO3溶液,又得到白色沉淀B.
根据上述现象判断:
①A的化学式是 ,B的化学式是 .
②原白色粉末中一定含有 ,可能含有 .对可能含有的物质,可通过 (填实验名称)进一步检验.检验操作步骤有:①蘸取待测液②置于酒精灯火焰上灼烧③透过蓝色钴玻璃观察④用稀盐酸洗净铂丝.其中正确的操作顺序为 .
A.①②③④B.④①②③C.④②①②③④D.①③②④ 查看习题详情和答案>>
(1)将复杂硅酸盐改写成氧化物形式:KAlSi3O8:
(2)有一包白色粉末可能由K2SO4、NaHCO3、BaCl2、FeCl3、KCl五种物质中的某几种组成,现进行如下实验:
①将白色粉末加水溶解,得无色溶液.
②向①中所得的无色溶液中加入NaOH溶液,观察到有白色沉淀A生成,过滤后,向滤液中滴加硝酸酸化的AgNO3溶液,又得到白色沉淀B.
根据上述现象判断:
①A的化学式是
②原白色粉末中一定含有
A.①②③④B.④①②③C.④②①②③④D.①③②④ 查看习题详情和答案>>
填空题:
(1)下列实验操作不正确的是 (填字母代号).
A.在催化剂存在的条件下,苯和溴水发生反应可生成无色、比水重的液体溴苯.
B.将铜丝弯成螺旋状,在酒精灯上加热变黑后,立即伸入盛有无水乙醇的试管中,完成乙醇氧化为乙醛的实验.
C.醇中含有少量水可加入生石灰再蒸馏制得无水乙醇.
D.验证蔗糖的水解产物时,将蔗糖和稀H2SO4溶液混合,水浴加热使其充分水解,然后用稀的NaOH溶液使其呈碱性后,再滴加银氨溶液.
F.验证溴乙烷水解产物时,将溴乙烷和氢氧化钠溶液混合,充分振荡溶液、静置、待液体分层后,滴加硝酸银溶液.
G.实验室蒸馏石油时温度计水银球插入石油中测量温度,收集60℃~150℃馏分得到汽油.
查看习题详情和答案>>
(1)下列实验操作不正确的是
A.在催化剂存在的条件下,苯和溴水发生反应可生成无色、比水重的液体溴苯.
B.将铜丝弯成螺旋状,在酒精灯上加热变黑后,立即伸入盛有无水乙醇的试管中,完成乙醇氧化为乙醛的实验.
C.醇中含有少量水可加入生石灰再蒸馏制得无水乙醇.
D.验证蔗糖的水解产物时,将蔗糖和稀H2SO4溶液混合,水浴加热使其充分水解,然后用稀的NaOH溶液使其呈碱性后,再滴加银氨溶液.
F.验证溴乙烷水解产物时,将溴乙烷和氢氧化钠溶液混合,充分振荡溶液、静置、待液体分层后,滴加硝酸银溶液.
G.实验室蒸馏石油时温度计水银球插入石油中测量温度,收集60℃~150℃馏分得到汽油.
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选择其中一题,并在相应的答题区域内作答.若两题都做,则按A题评分.
A:
合成氨是人类科学技术上的一项重大突破,是化学和技术对社会发展与进步的巨大贡献之一.在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒.除去CO的化学反应方程式(HAc表示醋酸):Cu(NH3)2Ac+CO+NH3=Cu(NH3)3(CO)Ac
请回答下列问题:
(1)C、N、O的第一电离能由大到小的顺序为 .
(2)写出基态Cu+的核外电子排布式 .
(3)配合物Cu(NH3)3(CO)Ac中心原子的配位数为 .
(4)写出与CO互为等电子体的离子 .(任写一个)
(5)在一定条件下NH3与CO2能合成化肥尿素[CO(NH2)2],尿素中 C原子轨道的杂化类型分别为 ;1mol尿素分子中,σ键的数目为 .
(6)铜金合金形成的晶胞如图1所示,其中Cu、Au原子个数比为 .
B:
对氨基苯磺酸是制取染料和一些药物的重要中间体,可由苯胺磺化得到.
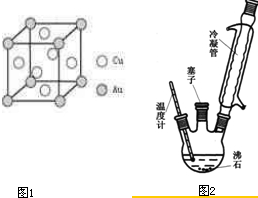
实验室可利用如图2实验装置合成对氨基苯磺酸.实验步骤如下:
1在一个250mL三颈烧瓶中加入10mL苯胺及几粒沸石,将三颈烧瓶放入冷水中冷却,小心地加入18mL浓硫酸.
2将三颈烧瓶置于油浴中缓慢加热至170~180℃,维持此温度2~2.5h.
③将反应液冷却至约50℃后,倒入盛有100mL冷水的烧杯中,用玻璃棒不断搅拌,促使晶体析出,抽滤,用少量冷水洗涤,得到的晶体是对氨基苯磺酸粗产品.
④将粗产品用沸水溶解,冷却结晶(若溶液颜色过深,可用活性炭脱色),抽滤,收集产品,晾干.(说明:100mL水在20℃时可溶解对氨基苯磺酸1.08g,在100℃时可溶解6.67g.)
试回答填空.
(1)装置中冷凝管的作用是 .
(2)步骤②中采用油浴加热,下列说法正确的是 (填序号).
A.用油浴加热的好处是反应物受热均匀,便于控制温度
B.此处也可以改用水浴加热
C.实验装置中的温度计可以改变位置,也可使其水银球浸入在油中
(3)步骤③用少量冷水洗涤晶体的好处是 .
(4)步骤③和④均进行抽滤操作,在抽滤完毕停止抽滤时,应注意先 ,然后 ,以防倒吸.
(5)步骤④中有时需要将“粗产品用沸水溶解,冷却结晶,抽滤”的操作进行多次,其目的是 .每次抽滤后均应将母液收集起来,进行适当处理,其目的是 .
查看习题详情和答案>>
A:
合成氨是人类科学技术上的一项重大突破,是化学和技术对社会发展与进步的巨大贡献之一.在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒.除去CO的化学反应方程式(HAc表示醋酸):Cu(NH3)2Ac+CO+NH3=Cu(NH3)3(CO)Ac
请回答下列问题:
(1)C、N、O的第一电离能由大到小的顺序为
(2)写出基态Cu+的核外电子排布式
(3)配合物Cu(NH3)3(CO)Ac中心原子的配位数为
(4)写出与CO互为等电子体的离子
(5)在一定条件下NH3与CO2能合成化肥尿素[CO(NH2)2],尿素中 C原子轨道的杂化类型分别为
(6)铜金合金形成的晶胞如图1所示,其中Cu、Au原子个数比为
B:
对氨基苯磺酸是制取染料和一些药物的重要中间体,可由苯胺磺化得到.

实验室可利用如图2实验装置合成对氨基苯磺酸.实验步骤如下:
1在一个250mL三颈烧瓶中加入10mL苯胺及几粒沸石,将三颈烧瓶放入冷水中冷却,小心地加入18mL浓硫酸.
2将三颈烧瓶置于油浴中缓慢加热至170~180℃,维持此温度2~2.5h.
③将反应液冷却至约50℃后,倒入盛有100mL冷水的烧杯中,用玻璃棒不断搅拌,促使晶体析出,抽滤,用少量冷水洗涤,得到的晶体是对氨基苯磺酸粗产品.
④将粗产品用沸水溶解,冷却结晶(若溶液颜色过深,可用活性炭脱色),抽滤,收集产品,晾干.(说明:100mL水在20℃时可溶解对氨基苯磺酸1.08g,在100℃时可溶解6.67g.)
试回答填空.
(1)装置中冷凝管的作用是
(2)步骤②中采用油浴加热,下列说法正确的是
A.用油浴加热的好处是反应物受热均匀,便于控制温度
B.此处也可以改用水浴加热
C.实验装置中的温度计可以改变位置,也可使其水银球浸入在油中
(3)步骤③用少量冷水洗涤晶体的好处是
(4)步骤③和④均进行抽滤操作,在抽滤完毕停止抽滤时,应注意先
(5)步骤④中有时需要将“粗产品用沸水溶解,冷却结晶,抽滤”的操作进行多次,其目的是