摘要:有一包白色粉末是由Na2SO4.K2CO3.KNO3.BaCl2中的两种化合物组成.其焰色反应为紫色,当加水配成溶液时.有沉淀生成. 填写下列空白: (1)此白色粉末由 和 组成. (2)生成沉淀反应的化学方程式为 . (3)若取少量粉末加入试管中.再滴加稀盐酸.有气泡产生.写出有关的离子反应方程式 .
网址:http://m.1010jiajiao.com/timu3_id_205669[举报]
有一包白色粉末是由两种白色固体组成,现进行如下实验:
①加入过量水,有白色沉淀②加入盐酸,粉末溶解放出气体,再加入稀硫酸又有白色沉淀;③粉末放入试管加热,试管口有液滴凝聚,该液滴能使无水硫酸铜变蓝,则这种混合物是
[
]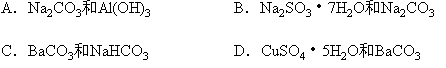
填空题
(1)将复杂硅酸盐改写成氧化物形式:KAlSi3O8: .
(2)有一包白色粉末可能由K2SO4、NaHCO3、BaCl2、FeCl3、KCl五种物质中的某几种组成,现进行如下实验:
①将白色粉末加水溶解,得无色溶液.
②向①中所得的无色溶液中加入NaOH溶液,观察到有白色沉淀A生成,过滤后,向滤液中滴加硝酸酸化的AgNO3溶液,又得到白色沉淀B.
根据上述现象判断:
①A的化学式是 ,B的化学式是 .
②原白色粉末中一定含有 ,可能含有 .对可能含有的物质,可通过 (填实验名称)进一步检验.检验操作步骤有:①蘸取待测液②置于酒精灯火焰上灼烧③透过蓝色钴玻璃观察④用稀盐酸洗净铂丝.其中正确的操作顺序为 .
A.①②③④B.④①②③C.④②①②③④D.①③②④ 查看习题详情和答案>>
(1)将复杂硅酸盐改写成氧化物形式:KAlSi3O8:
(2)有一包白色粉末可能由K2SO4、NaHCO3、BaCl2、FeCl3、KCl五种物质中的某几种组成,现进行如下实验:
①将白色粉末加水溶解,得无色溶液.
②向①中所得的无色溶液中加入NaOH溶液,观察到有白色沉淀A生成,过滤后,向滤液中滴加硝酸酸化的AgNO3溶液,又得到白色沉淀B.
根据上述现象判断:
①A的化学式是
②原白色粉末中一定含有
A.①②③④B.④①②③C.④②①②③④D.①③②④ 查看习题详情和答案>>
有一包白色粉末可能由K2SO4、NaHCO3、BaCl2、FeCl3、KCl、NH4NO3六种物质中的某几种组成,现进行如下实验:
(1)将白色粉末加水溶解,得无色溶液.
(2)向(1)中所得的无色溶液中加入NaOH溶液并加热,仅观察到有白色沉淀A生成,过滤后,向滤液中滴加硝酸酸化的AgNO3溶液,又得到白色沉淀B.
根据上述现象判断:
(1)白色沉淀A的化学式是
(2)原白色粉末中一定含有
查看习题详情和答案>>
(1)将白色粉末加水溶解,得无色溶液.
(2)向(1)中所得的无色溶液中加入NaOH溶液并加热,仅观察到有白色沉淀A生成,过滤后,向滤液中滴加硝酸酸化的AgNO3溶液,又得到白色沉淀B.
根据上述现象判断:
(1)白色沉淀A的化学式是
BaCO3
BaCO3
.(2)原白色粉末中一定含有
NaHCO3、BaCl2
NaHCO3、BaCl2
,可能含有KCl
KCl
.