网址:http://m.1010jiajiao.com/timu3_id_205587[举报]
完成下列计算:
(1)将4.6g金属钠投入100克水中,充分反应.已知:2Na+2H2O→2NaOH+H2↑
①生成标准状况下氢气
②求反应后溶液中NaOH的质量分数
(2)将10g CO和CO2的混合气体,通过装有足量过氧化钠的干燥管,反应后干燥管的总质量增加了5.6g.
已知:2Na2O2+2CO2→2Na2CO3+O2,求原混合气体中CO2的质量分数.计算过程:
(3)NaHCO3在潮湿的空气中会缓慢分解,Na2CO3会吸收空气中的水分:
Na2CO3+nH2O→Na2CO3?nH2O(n为平均值,n≤10).
取没有妥善保管已部分变质的NaHCO3样品A 9.16g,溶于水配成溶液,慢慢滴入稀盐酸并不停地搅拌,加入盐酸的体积与生成的CO2的体积(标准状况)如下表.(不计溶于水的CO2气体)
| 盐酸体积(mL) | 8 | 15 | 20 | 50 | x | 120 | 150 |
| 生成CO2体积(mL) | 0 | 112 | 224 | 896 | 2240 | 2240 | 2240 |
Na2CO3+HCl→NaHCO3+NaCl NaHCO3+HCl→NaCl+CO2↑+H2O
试求:
①滴入稀盐酸的物质的量浓度为:
②当加入盐酸后,生成CO2体积不再增加时,x的最小值为
③部分变质后样品A中:NaHCO3的物质的量;Na2CO3?nH2O的物质的量以及n值.计算过程:
“氢能”将是未来最理想的新能源。
Ⅰ.实验测得,1g氢气燃烧生成液态水时放出142.9kJ热量,则氢气燃烧的热化学方程式为_______。(填序号)
A.2H2(g)+O2(g) ![]() 2H2O(l) △H= -142.9kJ·mol—1
2H2O(l) △H= -142.9kJ·mol—1
B.H2(g)+1/2 O2(g) ![]() H2O(l) △H= -285.8kJ·mol—1
H2O(l) △H= -285.8kJ·mol—1
C.2H2+O2![]() 2H2O(l) △H= -571.6kJ·mol—1
2H2O(l) △H= -571.6kJ·mol—1
D.H2(g)+1/2O2(g) ![]() H2O(g) △H= -285.8kJ·mol—1
H2O(g) △H= -285.8kJ·mol—1
Ⅱ.某化学家根据“原子经济”的思想,设计了如下制备H2的反应步骤
①CaBr2+H2O![]() CaO+2HBr ②2HBr+Hg
CaO+2HBr ②2HBr+Hg![]() HgBr2+H2
HgBr2+H2
③HgBr2+_____![]() ______________ ④2HgO
______________ ④2HgO 2Hg+O2↑
2Hg+O2↑
请你根据“原子经济”的思想完成上述步骤③的化学方程式:____________。
根据“绿色化学”的思想评估该方法制H2的主要缺点:______________。
Ⅲ.利用核能把水分解制氢气,是目前正在研究的课题。下图是其中的一种流程,其中用了过量的碘。(提示:反应②的产物是O2、SO2和H2O)

完成下列反应的化学方程式:
反应①__________________________;反应②__________________________。
此法制取氢气的最大优点是_______________________________________________。
Ⅳ.氢气通常用生产水煤气的方法制得。其中CO(g)+ H2O(g) CO2(g)+ H2(g); △H<0。
在850℃时,K=1。
(1)若升高温度到950℃时,达到平衡时K______1(填“大于”、“小于”或“等于”)
(2)850℃时,若向一容积可变的密闭容器中同时充入 1.0 mol CO、3.0molH2O、1.0mol CO2 和 x mol H2,则:
①当x=5.0时,上述平衡向___________(填正反应或逆反应)方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是__________。
(3)在850℃时,若设x=5.0mol和x=6.0mol,其它物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a_______ b(填“大于”、“小于”或“等于”)。
Ⅴ.氢气还原氧化铜所得的红色固体可能是铜与氧化亚铜的混合物,已知Cu2O在酸性溶液中可发生自身氧化还原反应,生成Cu2+和单质铜。
(1)现有8克氧化铜被氢气还原后,得到红色固体6.8克,其中含单质铜与氧化亚铜的物质的量之比是 ;
(2)若将6.8克上述混合物与足量的稀硫酸充分反应后过滤,可得到固体 g;
(3)若将6.8克上述混合物与一定量的浓硝酸充分反应,
①生成标准状况下1.568升的气体(不考虑NO2的溶解,也不考虑NO2与N2O4的转化),则该气体的成分是 ,其物质的量之比是 ;
②把得到的溶液小心蒸发浓缩,把析出的晶体过滤,得晶体23.68g。经分析,原溶液中的Cu2+有20%残留在母液中。求所得晶体的化学式
查看习题详情和答案>>
“氢能”将是未来最理想的新能源.
Ⅰ.实验测得,1 g氢气燃烧生成液态水时放出142.9 kJ热量,则氢气燃烧的热化学方程式为________.(填序号)
A.
2H2(g)+O2(g)B.H2(g)+1/2O2(g)![]() H2O(l) ΔH=-285.8 kJ·mol-1
H2O(l) ΔH=-285.8 kJ·mol-1
C.2H2+O2![]() 2H2O(l) ΔH=-571.6 kJ·mol-1
2H2O(l) ΔH=-571.6 kJ·mol-1
D.H2(g)+1/2O2(g)![]() H2O(g) ΔH=-285.8 kJ·mol-1
H2O(g) ΔH=-285.8 kJ·mol-1
Ⅱ
.某化学家根据“原子经济”的思想,设计了如下制备H2的反应步骤①CaBr2+H2O CaO+2HBr
CaO+2HBr
②2HBr+Hg HgBr2+H2
HgBr2+H2
③HgBr2+________ ________
________
④2HgO 2Hg+O2↑
2Hg+O2↑
请你根据“原子经济”的思想完成上述步骤③的化学方程式:________.
根据“
绿色化学”的思想评估该方法制H2的主要缺点:________.Ⅲ
.利用核能把水分解制氢气,是目前正在研究的课题.下图是其中的一种流程,其中用了过量的碘.(提示:反应②的产物是O2、SO2和H2O)
完成下列
反应的化学方程式:反应①________;反应②________.
此法制取
氢气的最大优点是________.Ⅳ
.氢气通常用生产水煤气的方法制得.其中CO(g)+H2O(g)(1)若升高温度到950℃时,达到平衡时K________1(填“大于”、“小于”或“等于”)
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0 mol CO、3.0 mol H2O、1.0 mol CO2和x mol H2,则:
①当x=5.0时,上述平衡向________(填正反应或逆反应)方向进行.
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是________.
(3)在850℃时,若设x=5.0 mol和x=6.0 mol,其它物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a________b(填“大于”、“小于”或“等于”).
Ⅴ
.氢气还原氧化铜所得的红色固体可能是铜与氧化亚铜的混合物,已知Cu2O在酸性溶液中可发生自身氧化还原反应,生成Cu2+和单质铜.(1)现有8克氧化铜被氢气还原后,得到红色固体6.8克,其中含单质铜与氧化亚铜的物质的量之比是________;
(2)若将6.8克上述混合物与足量的稀硫酸充分反应后过滤,可得到固体________g;
(3)若将6.8克上述混合物与一定量的浓硝酸充分反应,
①生成标准状况下1.568升的气体(不考虑NO2的溶解,也不考虑NO2与N2O4的转化),则该气体的成分是________,其物质的量之比是________;
②把得到的溶液小心蒸发浓缩,把析出的晶体过滤,得晶体23.68 g.经分析,原溶液中的Cu2+有20%残留在母液中.求所得晶体的化学式
“氢能”将是未来最理想的新能源。
Ⅰ.实验测得,1g氢气燃烧生成液态水时放出142.9kJ热量,则氢气燃烧的热化学方程式为_______。(填序号)
A.2H2(g)+O2(g)  2H2O(l)
△H= -142.9kJ·mol—1
2H2O(l)
△H= -142.9kJ·mol—1
B.H2(g)+1/2 O2(g)  H2O(l)
△H= -285.8kJ·mol—1
H2O(l)
△H= -285.8kJ·mol—1
C.2H2+O2 2H2O(l)
△H= -571.6kJ·mol—1
2H2O(l)
△H= -571.6kJ·mol—1
D.H2(g)+1/2
O2(g)  H2O(g) △H= -285.8kJ·mol—1
H2O(g) △H= -285.8kJ·mol—1
Ⅱ.某化学家根据“原子经济”的思想,设计了如下制备H2的反应步骤
①CaBr2+H2O CaO+2HBr ②2HBr+Hg
CaO+2HBr ②2HBr+Hg HgBr2+H2
HgBr2+H2
③HgBr2+_____ ______________
④2HgO
______________
④2HgO 2Hg+O2↑
2Hg+O2↑
请你根据“原子经济”的思想完成上述步骤③的化学方程式:____________。
根据“绿色化学”的思想评估该方法制H2的主要缺点:______________。
Ⅲ.利用核能把水分解制氢气,是目前正在研究的课题。下图是其中的一种流程,其中用了过量的碘。(提示:反应②的产物是O2、SO2和H2O)

完成下列反应的化学方程式:
反应①__________________________;反应②__________________________。
此法制取氢气的最大优点是_______________________________________________。
Ⅳ.氢气通常用生产水煤气的方法制得。其中CO(g)+ H2O(g) 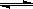 CO2(g)+ H2(g); △H<0。
CO2(g)+ H2(g); △H<0。
在850℃时,K=1。
(1)若升高温度到950℃时,达到平衡时K______1(填“大于”、“小于”或“等于”)
(2)850℃时,若向一容积可变的密闭容器中同时充入 1.0 mol CO、3.0molH2O、1.0mol CO2 和 x mol H2,则:
①当x=5.0时,上述平衡向___________(填正反应或逆反应)方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是__________。
(3)在850℃时,若设x=5.0 mol和x=6.0mol,其它物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a _______ b(填“大于”、“小于”或“等于”)。
Ⅴ.氢气还原氧化铜所得的红色固体可能是铜与氧化亚铜的混合物,已知Cu2O在酸性溶液中可发生自身氧化还原反应,生成Cu2+和单质铜。
(1)现有8克氧化铜被氢气还原后,得到红色固体6.8克,其中含单质铜与氧化亚铜的物质的量之比是 ;
(2)若将6.8克上述混合物与足量的稀硫酸充分反应后过滤,可得到固体 g;
(3)若将6.8克上述混合物与一定量的浓硝酸充分反应,
①生成标准状况下1.568升的气体(不考虑NO2的溶解,也不考虑NO2与N2O4的转化),则该气体的成分是 ,其物质的量之比是 ;
②把得到的溶液小心蒸发浓缩,把析出的晶体过滤,得晶体23.68g。经分析,原溶液中的Cu2+有20%残留在母液中。求所得晶体的化学式
查看习题详情和答案>>
“氢能”将是未来最理想的新能源。
Ⅰ.实验测得,1g氢气燃烧生成液态水时放出142.9kJ热量,则氢气燃烧的热化学方程式为_______。(填序号)
A.2H2(g)+O2(g)  2H2O(l)△H= -142.9kJ·mol—1 2H2O(l)△H= -142.9kJ·mol—1 |
B.H2(g)+1/2 O2(g)  H2O(l)△H= -285.8kJ·mol—1 H2O(l)△H= -285.8kJ·mol—1 |
C.2H2+O2 2H2O(l)△H= -571.6kJ·mol—1 2H2O(l)△H= -571.6kJ·mol—1 |
D.H2(g)+1/2 O2(g)  H2O(g) △H= -285.8kJ·mol—1 H2O(g) △H= -285.8kJ·mol—1 |
①CaBr2+H2O
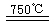 CaO+2HBr ②2HBr+Hg
CaO+2HBr ②2HBr+Hg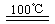 HgBr2+H2
HgBr2+H2③HgBr2+_____
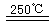 ______________ ④2HgO
______________ ④2HgO 2Hg+O2↑
2Hg+O2↑请你根据“原子经济”的思想完成上述步骤③的化学方程式:____________。
根据“绿色化学”的思想评估该方法制H2的主要缺点:______________。
Ⅲ.利用核能把水分解制氢气,是目前正在研究的课题。下图是其中的一种流程,其中用了过量的碘。(提示:反应②的产物是O2、SO2和H2O)
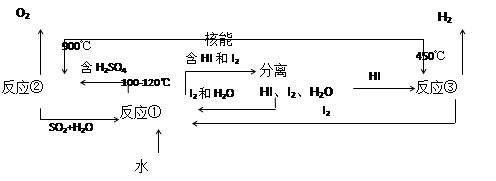
完成下列反应的化学方程式:
反应①__________________________;反应②__________________________。
此法制取氢气的最大优点是_______________________________________________。
Ⅳ.氢气通常用生产水煤气的方法制得。其中CO(g)+ H2O(g)
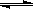 CO2(g)+ H2(g); △H<0。
CO2(g)+ H2(g); △H<0。在850℃时,K=1。
(1)若升高温度到950℃时,达到平衡时K______1(填“大于”、“小于”或“等于”)
(2)850℃时,若向一容积可变的密闭容器中同时充入 1.0 mol CO、3.0molH2O、1.0mol CO2和 x mol H2,则:
①当x=5.0时,上述平衡向___________(填正反应或逆反应)方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是__________。
(3)在850℃时,若设x=5.0 mol和x=6.0mol,其它物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a _______ b(填“大于”、“小于”或“等于”)。
Ⅴ.氢气还原氧化铜所得的红色固体可能是铜与氧化亚铜的混合物,已知Cu2O在酸性溶液中可发生自身氧化还原反应,生成Cu2+和单质铜。
(1)现有8克氧化铜被氢气还原后,得到红色固体6.8克,其中含单质铜与氧化亚铜的物质的量之比是 ;
(2)若将6.8克上述混合物与足量的稀硫酸充分反应后过滤,可得到固体 g;
(3)若将6.8克上述混合物与一定量的浓硝酸充分反应,
①生成标准状况下1.568升的气体(不考虑NO2的溶解,也不考虑NO2与N2O4的转化),则该气体的成分是 ,其物质的量之比是 ;
②把得到的溶液小心蒸发浓缩,把析出的晶体过滤,得晶体23.68g。经分析,原溶液中的Cu2+有20%残留在母液中。求所得晶体的化学式 查看习题详情和答案>>