摘要:5.在下列分子或离子中既具有还原性又具有氧化性的是( ) A. B. C. D.
网址:http://m.1010jiajiao.com/timu3_id_205177[举报]
(15分)
(1)(3分)现有下列物质:维生素A、维生素C、碘元素、铁元素、淀粉、油脂。请选择正确答案填在相应的空格里。
①人体缺乏某种维生素会引起坏血病,这种维生素是__ __。
②人体缺乏某种微量元素会发生贫血,这种微量元素是____ __。
③既能为人体提供热量,又能提供必需脂肪酸的物质是____ _ ___。
___。
(2)(5分)了解一些用药常识,有利于自我保健。现有下列药物:碳酸镁、青霉素、阿司匹林、氢氧化铝。
①其中属于解热镇痛的药物是___ ___。
②青霉素的作用是__ _。
③碳酸镁可治疗胃酸过多的原理是 (用离子方程表示)。
④药片常用淀粉作为黏合剂,淀粉水解的最终产物是____ ____。
(3)(7分)生活中处处有化学,化学已渗透到我们的“衣、食、住、行”之中。
①衣:鉴别真假羊毛衫的方法是先取样,再_ _ __。
_ __。
②食:水是人类生存的必需物质。在净水过程中,明矾作为 剂;氯气或漂白粉作为 剂。
③住:玻璃和钢铁是常用的建筑材料。普通玻璃是由___ ____等物质组成的;钢铁制品不仅可发生化学腐蚀,在潮湿的空气中还能发生____ ____腐蚀。
④行:铝可用于制造交通工具,铝制品不易生锈的原因是____ ____;橡胶是制造轮胎的重要原料,天然橡胶通过____ _____措施可增大强度和弹性。
(15分)
(1)(3分)现有下列物质:维生素A、维生素C、碘元素、铁元素、淀粉、油脂。请选择正确答案填在相应的空格里。
①人体缺乏某种维生素会引起坏血病,这种维生素是__ __。
②人体缺乏某种微量元素会发生贫血,这种微量元素是____ __。
③既能为人体提供热量,又能提供必需脂肪酸的物质是____ _ ___。
___。
(2)(5分)了解一些用药常识,有利于自我保健。现有下列药物:碳酸镁、青霉素、阿司匹林、氢氧化铝。
①其中属于解热镇痛的药物是___ ___。
②青霉素的作用是__ _。
③碳酸镁可治疗胃酸过多的原理是 (用离子方程表示)。
④药片常用淀粉作为黏合剂,淀粉水解的最终产物是____ ____。
(3)(7分)生活中处处有化学,化学已渗透到我们的“衣、食、住、行”之中。
①衣:鉴别真假羊毛衫的方法是先取样,再_ _ __。
_ __。
②食:水是人类生存的必需物质。在净水过程中,明矾作为 剂;氯气或漂白粉作为 剂。
③住:玻璃和钢铁是常用的建筑材料。普通玻璃是由___ ____等物质组成的;钢铁制品不仅可发生化学腐蚀,在潮湿的空气中还能发生____ ____腐蚀。
④行:铝可用于制造交通工具,铝制品不易生锈的原因是____ ____;橡胶是制造轮胎的重要原料,天然橡胶通过____ _____措施可增大强度和弹性。
(1)(3分)现有下列物质:维生素A、维生素C、碘元素、铁元素、淀粉、油脂。请选择正确答案填在相应的空格里。
①人体缺乏某种维生素会引起坏血病,这种维生素是__ __。
②人体缺乏某种微量元素会发生贫血,这种微量元素是____ __。
③既能为人体提供热量,又能提供必需脂肪酸的物质是____ _
 ___。
___。(2)(5分)了解一些用药常识,有利于自我保健。现有下列药物:碳酸镁、青霉素、阿司匹林、氢氧化铝。
①其中属于解热镇痛的药物是___ ___。
②青霉素的作用是__ _。
③碳酸镁可治疗胃酸过多的原理是 (用离子方程表示)。
④药片常用淀粉作为黏合剂,淀粉水解的最终产物是____ ____。
(3)(7分)生活中处处有化学,化学已渗透到我们的“衣、食、住、行”之中。
①衣:鉴别真假羊毛衫的方法是先取样,再_
 _ __。
_ __。②食:水是人类生存的必需物质。在净水过程中,明矾作为 剂;氯气或漂白粉作为 剂。
③住:玻璃和钢铁是常用的建筑材料。普通玻璃是由___ ____等物质组成的;钢铁制品不仅可发生化学腐蚀,在潮湿的空气中还能发生____ ____腐蚀。
④行:铝可用于制造交通工具,铝制品不易生锈的原因是____ ____;橡胶是制造轮胎的重要原料,天然橡胶通过____ _____措施可增大强度和弹性。
硫、氮及其化合物与人类的生活有着密切关系
ⅠNO分子因污染空气而臭名昭著.近年来,发现少量的NO在生物体内许多组织中存在,它有扩张血管、免疫、增强记忆的功能,而成为当前生命科学的研究的热点,NO亦被称为“明星分子”.请回答下列问题.
(1)NO的危害在于
A.破坏臭氧层 B.高温下能使一些金属氧化
C.造成酸雨 D.与人体血红蛋白结合
(2)在含Cu+离子的酶的活化中心中,亚硝酸根离子可转化为NO,写出Cu+和亚硝酸根离子(NO2-)在酸性水溶液中反应的离子方程式:
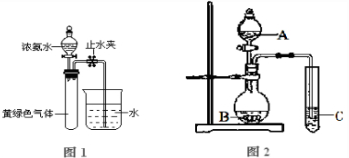
(3)已知NH3和Cl2会发生氧化还原反应,生成N2和NH4Cl.现用如图1所示的装置进行实验,打开分液漏斗的活塞,滴下浓氨水,至不再反应为止;关闭分液漏斗的活塞,待恢复到室温,打开止水夹,试管内液面上升至三分之二处.
①写出实验室制取氨气的化学方程式
②试管内发生反应的化学方程式是
③试管中发生的反应表明氨气具有
a、氧化性 b、还原性 c、碱性 d、热不稳定性
Ⅱ(1)将SO2通入由CuSO4和NaCl混合的浓溶液中,溶液颜色变浅,析出白色沉淀,取该沉淀进行元素质量分数分析,知其中含Cl:35.7%,Cu:64.3%,则SO2在上述反应中的作用是
a.漂白剂 b.氧化剂 c.还原剂
(2)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解.现改用H2O2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式
(3)用上图2实验装置可以证明硫、碳、硅三种元素的非金属性强弱.则A、B、C所代表的物质的名称:A
查看习题详情和答案>>
ⅠNO分子因污染空气而臭名昭著.近年来,发现少量的NO在生物体内许多组织中存在,它有扩张血管、免疫、增强记忆的功能,而成为当前生命科学的研究的热点,NO亦被称为“明星分子”.请回答下列问题.
(1)NO的危害在于
ACD
ACD
(填标号).A.破坏臭氧层 B.高温下能使一些金属氧化
C.造成酸雨 D.与人体血红蛋白结合
(2)在含Cu+离子的酶的活化中心中,亚硝酸根离子可转化为NO,写出Cu+和亚硝酸根离子(NO2-)在酸性水溶液中反应的离子方程式:
Cu++NO2-+2H+═Cu2++NO↑+H2O
Cu++NO2-+2H+═Cu2++NO↑+H2O
.(3)已知NH3和Cl2会发生氧化还原反应,生成N2和NH4Cl.现用如图1所示的装置进行实验,打开分液漏斗的活塞,滴下浓氨水,至不再反应为止;关闭分液漏斗的活塞,待恢复到室温,打开止水夹,试管内液面上升至三分之二处.
①写出实验室制取氨气的化学方程式
Ca(OH)2+2NH4Cl═CaCl2+2NH3↑+2H2O
Ca(OH)2+2NH4Cl═CaCl2+2NH3↑+2H2O
.②试管内发生反应的化学方程式是
8NH3+3Cl2═N2+6NH4Cl
8NH3+3Cl2═N2+6NH4Cl
.③试管中发生的反应表明氨气具有
bc
bc
(填标号).a、氧化性 b、还原性 c、碱性 d、热不稳定性

Ⅱ(1)将SO2通入由CuSO4和NaCl混合的浓溶液中,溶液颜色变浅,析出白色沉淀,取该沉淀进行元素质量分数分析,知其中含Cl:35.7%,Cu:64.3%,则SO2在上述反应中的作用是
c
c
(填标号).a.漂白剂 b.氧化剂 c.还原剂
(2)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解.现改用H2O2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式
Cu+2H++H2O2═Cu2++2H2O
Cu+2H++H2O2═Cu2++2H2O
.(3)用上图2实验装置可以证明硫、碳、硅三种元素的非金属性强弱.则A、B、C所代表的物质的名称:A
H2SO4
H2SO4
,BNaHCO3或Na2CO3
NaHCO3或Na2CO3
,CNa2SiO3
Na2SiO3
填化学式).