题目内容
|
在下列分子或离子中既具有还原性又具有氧化性的是 | |
A. |
Al3+ |
B. |
Cl- |
C. |
|
D. |
H2O2 |
答案:D
解析:
解析:
|
H2O2中氧元素化合价为-1,处于中间价态.既可作氧化剂,又可作还原剂. |

练习册系列答案
相关题目
判断含氧酸酸性强弱的一条经验规律是:含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性就越强.含氧酸酸性强弱与非羟基氧原子数的关系如下表所示:
(1)亚磷酸H3PO3和亚砷酸H3AsO3分子式相似,但它们的酸性差别很大,H3PO3是中强酸,H3AsO3既有弱酸性又有弱碱性.由此可推断它们的结构式分别为:① ;② .
(2)H3PO3和H3AsO3与过量的NaOH溶液反应的化学方程式分别是:① ;② .
(3)在H3PO3和H3AsO3中分别加入浓盐酸,化学方程式为: ; .
请按要求回答下列问题:
(4)指出下面物质分子或离子的空间构型:PO43- ;CS2 .
(5)有两种活性反应中间体微粒,它们的微粒中均含有1个碳原子和3个氢原子.根据下面给出的这两种微粒的球棍模型,写出相应的化学式:
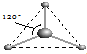 ;
;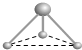 .
.
(6)按要求写出第二周期非金属元素构成的中性分子的化学式:平面形分子 ;三角锥形分子 ;四面体形分子 .
| 名称 | 次氯酸 | 磷酸 | 硫酸 | 高氯酸 |
| 结构式 | Cl-OH | 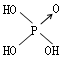 |
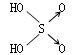 |
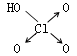 |
| 非羟基氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
(2)H3PO3和H3AsO3与过量的NaOH溶液反应的化学方程式分别是:①
(3)在H3PO3和H3AsO3中分别加入浓盐酸,化学方程式为:
请按要求回答下列问题:
(4)指出下面物质分子或离子的空间构型:PO43-
(5)有两种活性反应中间体微粒,它们的微粒中均含有1个碳原子和3个氢原子.根据下面给出的这两种微粒的球棍模型,写出相应的化学式:


(6)按要求写出第二周期非金属元素构成的中性分子的化学式:平面形分子
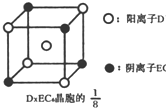
 示)位于该正方体的顶点和面心,该化合物的化学式是
示)位于该正方体的顶点和面心,该化合物的化学式是