摘要:35:如下图是某学生设计的制取氢气.并用氢气还原氧化铜的实验装置图.回答下列问题: (1)改正装置中的错误之处① .② .③ .(2)A试管中的药品名称是 .(3)B试管中反应的化学方程式 . (4)该实验步骤有:a.在试管A中装入药品 b.往试管B通入氢气.c.停止向试管B通氢气d停止加热试管B e.加热试管B f.氢气发生装置的气密性检查 g.检查氢气的纯度下列中表示正确操作顺序的一组是 .①faegbcd ②afgbedc ③faebdcg ④afgebcd ⑤fagbedc (5)试管B出现的实验现象是 .
网址:http://m.1010jiajiao.com/timu3_id_20492[举报]
某兴趣小组在复习铁的冶炼时,在参考资料上发现以下一段文字:已知在不同的温度下,CO与铁的氧化物反应能生成另一种铁的氧化物(或铁单质)和CO2.他们不禁产生了疑问:课本上册124页的实验中,CO与Fe2O3反应生成的黑色物质真的是Fe粉吗?于是他们进行了以下探究.
[查阅资料]
资料一:Fe粉和Fe3O4粉末能被磁铁吸引而FeO(黑色)不能;
资料二:Fe3O4中铁元素有+2、+3两种化合价,其化学式可用FeO?Fe2O3 的形式表示;
[提出猜想]黑色物质可能是Fe3O4、FeO和Fe粉中的一种或几种.
[进行实验]兴趣小组收集了CO与Fe2O3反应生成的黑色物质进行了下列实验:
[实验结论]
(1)甲实验现象说明黑色物质中没有
(2)生成的黑色物质应为Fe3O4;
(3)写出黑色粉末和热的盐酸反应的化学方程式
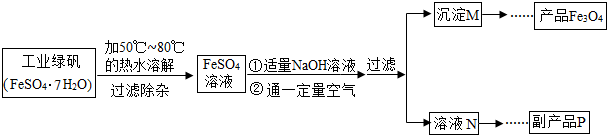
[拓展探究]同学们对Fe3O4产生了兴趣,从参考资料中找到了氧化沉淀法生产复印用高档Fe3O4粉的工艺流程简图.
[生产流程]
[查阅资料]
资料一:硫酸亚铁在不同温度下的溶解度如表所示:
资料二:Fe(OH)2受氧气氧化反应原理为:4Fe(OH)2+2H2O+O2=4Fe(OH)3
资料三:获得Fe3O4的反应原理为:Fe(OH)2+2Fe(OH)3
Fe3O4+4H2O
[问题讨论]
(1)溶解时,用50℃至80℃的热水目的是
(2)写出加入适量NaOH溶液时发生反应的化学方程式
(3)上述过程中,要控制“通一定量空气”的目的是
(4)要使四氧化三铁的产率最高,则上述流程中产生的Fe(OH)2和Fe(OH)3的最佳质量比为
(5)副产品P是硫酸钠,由溶液N获得该副产品的操作顺序是b→
a.过滤 b.加热浓缩 c.冷却结晶 d.晶体加热至完全失去结晶水
[组成确定]为确定用以上方法制得的四氧化三铁中可能含有的杂质,同学们又进行了下列实验探究.
[查阅资料]
资料一:难溶性碱受热时能分解产生金属氧化物和水(反应中各种元素的化合价不变);
资料二:Fe2O3和CO反应是随温度升高而逐步进行的,先生成Fe3O4,再生成FeO(黑色),最后生成Fe;
[提出猜想]Fe3O4中可能含有的杂质是Fe2O3和FeO中的一种或两种.
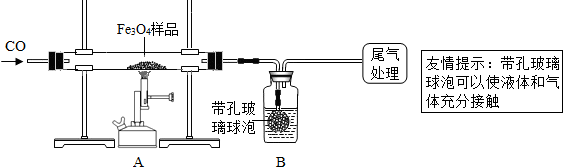
[实验设计]同学们称取了23.28g该Fe3O4样品进行了下列实验:
[实验分析]因探究思路不同,兴趣小组分成甲、乙两小组.
甲组:
(1)该组同学欲通过B装置反应前后的质量变化来计算确认该Fe3O4样品中的杂质.
B中的最佳试剂是
①澄清石灰水 ②氢氧化钠浓溶液 ③稀盐酸 ④水
(2)上述实验过程中,CO气体除作为反应物外,能起到的作用是:
①实验开始时,排尽装置中的空气,防止
②停止加热后,继续通CO气体,防止
在本实验中,CO气体还能起到的作用是③
(3)尾气如何处理?
乙组:
利用仪器测定并绘制成反应过程中A装置中玻璃管内的固体质量随温度的变化曲线(如图)
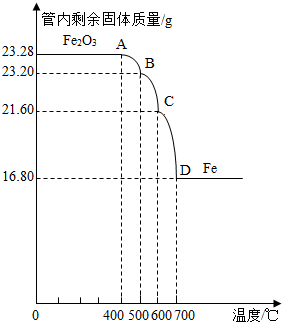
(1)写出BC段发生反应的化学方程式:
(2)通过分析计算确定:该Fe3O4样品中含有的杂质是
查看习题详情和答案>>
[查阅资料]
资料一:Fe粉和Fe3O4粉末能被磁铁吸引而FeO(黑色)不能;
资料二:Fe3O4中铁元素有+2、+3两种化合价,其化学式可用FeO?Fe2O3 的形式表示;
[提出猜想]黑色物质可能是Fe3O4、FeO和Fe粉中的一种或几种.
[进行实验]兴趣小组收集了CO与Fe2O3反应生成的黑色物质进行了下列实验:
| 实验方案 | 实验现象 | |
| 甲 | 取少量黑色物质用磁铁吸引 | 黑色物质全部被磁铁吸引 |
| 乙 | 取少量黑色物质加入30%热的盐酸中 | 无气泡、溶液颜色变成黄绿色 |
| 丙 | 取少量黑色物质加入硫酸铜溶液中 | 无任何现象 |
(1)甲实验现象说明黑色物质中没有
FeO
FeO
,乙、丙实验现象说明黑色物质中没有Fe
Fe
;(2)生成的黑色物质应为Fe3O4;
(3)写出黑色粉末和热的盐酸反应的化学方程式
Fe3O4+8HCl=FeCl2+2FeCl3+4H2O
Fe3O4+8HCl=FeCl2+2FeCl3+4H2O
;[拓展探究]同学们对Fe3O4产生了兴趣,从参考资料中找到了氧化沉淀法生产复印用高档Fe3O4粉的工艺流程简图.
[生产流程]

[查阅资料]
资料一:硫酸亚铁在不同温度下的溶解度如表所示:
| 温度/℃ | 0 | 10 | 30 | 50 | 60 | 70 | 80 | 90 |
| 溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.3 | 33.0 | 30.5 | 27.0 |
资料三:获得Fe3O4的反应原理为:Fe(OH)2+2Fe(OH)3
| ||
[问题讨论]
(1)溶解时,用50℃至80℃的热水目的是
在50℃~80℃时,硫酸亚铁的溶解度较大,有利于溶解的更多,提高产率
在50℃~80℃时,硫酸亚铁的溶解度较大,有利于溶解的更多,提高产率
.(2)写出加入适量NaOH溶液时发生反应的化学方程式
2NaOH+FeSO4═Fe(OH)2↓+Na2SO4
2NaOH+FeSO4═Fe(OH)2↓+Na2SO4
.(3)上述过程中,要控制“通一定量空气”的目的是
控制Fe(OH)2转化为Fe(OH)3的量
控制Fe(OH)2转化为Fe(OH)3的量
.(4)要使四氧化三铁的产率最高,则上述流程中产生的Fe(OH)2和Fe(OH)3的最佳质量比为
90:214
90:214
.(5)副产品P是硫酸钠,由溶液N获得该副产品的操作顺序是b→
c
c
→a
a
→d.a.过滤 b.加热浓缩 c.冷却结晶 d.晶体加热至完全失去结晶水
[组成确定]为确定用以上方法制得的四氧化三铁中可能含有的杂质,同学们又进行了下列实验探究.
[查阅资料]
资料一:难溶性碱受热时能分解产生金属氧化物和水(反应中各种元素的化合价不变);
资料二:Fe2O3和CO反应是随温度升高而逐步进行的,先生成Fe3O4,再生成FeO(黑色),最后生成Fe;
[提出猜想]Fe3O4中可能含有的杂质是Fe2O3和FeO中的一种或两种.
[实验设计]同学们称取了23.28g该Fe3O4样品进行了下列实验:

[实验分析]因探究思路不同,兴趣小组分成甲、乙两小组.
甲组:
(1)该组同学欲通过B装置反应前后的质量变化来计算确认该Fe3O4样品中的杂质.
B中的最佳试剂是
②
②
(填序号)①澄清石灰水 ②氢氧化钠浓溶液 ③稀盐酸 ④水
(2)上述实验过程中,CO气体除作为反应物外,能起到的作用是:
①实验开始时,排尽装置中的空气,防止
防止爆炸
防止爆炸
;②停止加热后,继续通CO气体,防止
防止生成物被氧化
防止生成物被氧化
,以及B中的溶液倒吸入A中;在本实验中,CO气体还能起到的作用是③
让二氧化碳全部进入B瓶中
让二氧化碳全部进入B瓶中
.(3)尾气如何处理?
点燃
点燃
.乙组:
利用仪器测定并绘制成反应过程中A装置中玻璃管内的固体质量随温度的变化曲线(如图)

(1)写出BC段发生反应的化学方程式:
Fe3O4+CO
3FeO+CO2
| ||
Fe3O4+CO
3FeO+CO2
;
| ||
(2)通过分析计算确定:该Fe3O4样品中含有的杂质是
Fe2O3
Fe2O3
.(不需要写过程)(2011?丹阳市二模)某兴趣小组在复习铁的冶炼时,在参考资料上发现以下一段文字:已知在不同的温度下,CO与铁的氧化物反应能生成另一种铁的氧化物(或铁单质)和CO2.他们不禁产生了疑问:书本119页的实验中,CO与Fe2O3反应生成的黑色物质真的是Fe粉吗?于是他们进行了以下探究.
【查阅资料】
资料一:Fe粉和Fe3O4粉末能被磁铁吸引而FeO(黑色)不能;
资料二:Fe3O4中铁元素有+2、+3两种化合价,其化学式可用FeO?Fe2O3 的形式表示;
【提出猜想】黑色物质可能是Fe3O4、FeO和Fe粉中的一种或几种.
【进行实验】兴趣小组收集了CO与Fe2O3反应生成的黑色物质进行了下列实验:
【实验结论】
(1)甲实验现象说明黑色物质中没有
(2)生成的黑色物质应为Fe3O4;
(3)写出黑色粉末和热的盐酸反应的化学方程式
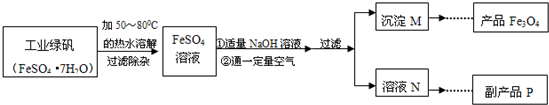
【拓展探究】同学们对Fe3O4产生了兴趣,从参考资料中找到了氧化沉淀法生产复印用高档Fe3O4粉的工艺流程简图.
【生产流程】
【查阅资料】
资料一:硫酸亚铁在不同温度下的溶解度如下表所示:
资料二:Fe(OH)2受氧气氧化反应原理为:4Fe(OH)2+2H2O+O2=4Fe(OH)3
资料三:获得Fe3O4的反应原理为:Fe(OH)2+2Fe(OH)3
Fe3O4+4H2O
【问题讨论】
(1)溶解时,用50℃至80℃的热水目的是
(2)写出加入适量NaOH溶液时发生反应的化学方程式
(3)上述过程中,要控制“通一定量空气”的目的是
(4)要使四氧化三铁的产率最高,则上述流程中产生的Fe(OH)2和Fe(OH)3的最佳质量比为
(5)副产品P是硫酸钠,由溶液N获得该副产品的操作顺序是b→
a.过滤 b.加热浓缩 c.冷却结晶 d.晶体加热至完全失去结晶水
【组成确定】为确定用以上方法制得的四氧化三铁中可能含有的杂质,同学们又进行了下列实验探究.
【查阅资料】
资料一:难溶性碱受热时能分解产生金属氧化物和水(反应中各种元素的化合价不变);
资料二:Fe2O3和CO反应是随温度升高而逐步进行的,先生成Fe3O4,再生成FeO(黑色),最后生成Fe;
【提出猜想】Fe3O4中可能含有的杂质是Fe2O3和FeO中的一种或两种.
【实验设计】同学们称取了23.28g该Fe3O4样品进行了下列实验: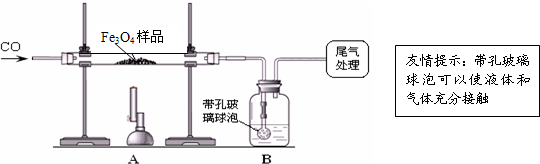
【实验分析】因探究思路不同,兴趣小组分成甲、乙两小组.
甲组:
(1)该组同学欲通过B装置反应前后的质量变化来计算确认该Fe3O4样品中的杂质.B中的最佳试剂是_
①澄清石灰水 ②氢氧化钠浓溶液 ③稀盐酸 ④水
(2)上述实验过程中,CO气体除作为反应物外,还能起到的作用是:①实验开始时,排尽装置中的空气,防止加热时发生爆炸;②停止加热后,防止A中生成物被氧化,B中的溶液倒吸入A中;③
(3)乙组同学认为B装置反应前后的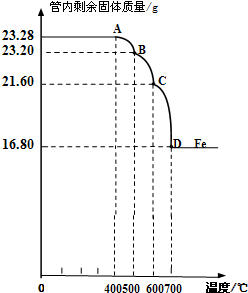 质量差会偏小而影响计算、分析,你认为他们的理由是
质量差会偏小而影响计算、分析,你认为他们的理由是
乙组:
利用仪器测定并绘制成反应过程中A装置中玻璃管内的固体质量随温度的变化曲线(右图).
(1)写出BC段发生反应的化学方程式:
(2)通过计算确定:该Fe3O4样品中含有的杂质是
查看习题详情和答案>>
【查阅资料】
资料一:Fe粉和Fe3O4粉末能被磁铁吸引而FeO(黑色)不能;
资料二:Fe3O4中铁元素有+2、+3两种化合价,其化学式可用FeO?Fe2O3 的形式表示;
【提出猜想】黑色物质可能是Fe3O4、FeO和Fe粉中的一种或几种.
【进行实验】兴趣小组收集了CO与Fe2O3反应生成的黑色物质进行了下列实验:
| 实验方案 | 实验现象 | |
| 甲 | 取少量黑色物质用磁铁吸引 | 黑色物质全部被磁铁吸引 |
| 乙 | 取少量黑色物质加入30%热的盐酸中 | 无气泡、溶液颜色变成黄绿色 |
| 丙 | 取少量黑色物质加入硫酸铜溶液中 | 无任何现象 |
(1)甲实验现象说明黑色物质中没有
FeO
FeO
,乙、丙实验现象说明黑色物质中没有Fe
Fe
;(2)生成的黑色物质应为Fe3O4;
(3)写出黑色粉末和热的盐酸反应的化学方程式
Fe3O4+8HCl═FeCl2+2FeCl3+4H2O
Fe3O4+8HCl═FeCl2+2FeCl3+4H2O
;【拓展探究】同学们对Fe3O4产生了兴趣,从参考资料中找到了氧化沉淀法生产复印用高档Fe3O4粉的工艺流程简图.
【生产流程】

【查阅资料】
资料一:硫酸亚铁在不同温度下的溶解度如下表所示:
| 温度/℃ | 0 | 10 | 30 | 50 | 60 | 70 | 80 | 90 |
| 溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.3 | 33.0 | 30.5 | 27.0 |
资料三:获得Fe3O4的反应原理为:Fe(OH)2+2Fe(OH)3
| ||
【问题讨论】
(1)溶解时,用50℃至80℃的热水目的是
在50℃~80℃时,硫酸亚铁的溶解度较大,有利于溶解的更多,提高产率
在50℃~80℃时,硫酸亚铁的溶解度较大,有利于溶解的更多,提高产率
.(2)写出加入适量NaOH溶液时发生反应的化学方程式
2NaOH+FeSO4═Fe(OH)2↓+Na2SO4
2NaOH+FeSO4═Fe(OH)2↓+Na2SO4
;(3)上述过程中,要控制“通一定量空气”的目的是
控制Fe(OH)2转化为Fe(OH)3的量[或防止Fe(OH)2完全转化为Fe(OH)3]
控制Fe(OH)2转化为Fe(OH)3的量[或防止Fe(OH)2完全转化为Fe(OH)3]
.(4)要使四氧化三铁的产率最高,则上述流程中产生的Fe(OH)2和Fe(OH)3的最佳质量比为
90:214(或45:107)
90:214(或45:107)
.(5)副产品P是硫酸钠,由溶液N获得该副产品的操作顺序是b→
c
c
→a
a
→d.a.过滤 b.加热浓缩 c.冷却结晶 d.晶体加热至完全失去结晶水
【组成确定】为确定用以上方法制得的四氧化三铁中可能含有的杂质,同学们又进行了下列实验探究.
【查阅资料】
资料一:难溶性碱受热时能分解产生金属氧化物和水(反应中各种元素的化合价不变);
资料二:Fe2O3和CO反应是随温度升高而逐步进行的,先生成Fe3O4,再生成FeO(黑色),最后生成Fe;
【提出猜想】Fe3O4中可能含有的杂质是Fe2O3和FeO中的一种或两种.
【实验设计】同学们称取了23.28g该Fe3O4样品进行了下列实验:

【实验分析】因探究思路不同,兴趣小组分成甲、乙两小组.
甲组:
(1)该组同学欲通过B装置反应前后的质量变化来计算确认该Fe3O4样品中的杂质.B中的最佳试剂是_
②
②
(填序号).①澄清石灰水 ②氢氧化钠浓溶液 ③稀盐酸 ④水
(2)上述实验过程中,CO气体除作为反应物外,还能起到的作用是:①实验开始时,排尽装置中的空气,防止加热时发生爆炸;②停止加热后,防止A中生成物被氧化,B中的溶液倒吸入A中;③
将装置中的CO2送入NaOH溶液中
将装置中的CO2送入NaOH溶液中
.(3)乙组同学认为B装置反应前后的
 质量差会偏小而影响计算、分析,你认为他们的理由是
质量差会偏小而影响计算、分析,你认为他们的理由是CO从B中溶液里逸出时会带出部分水蒸气
CO从B中溶液里逸出时会带出部分水蒸气
.乙组:
利用仪器测定并绘制成反应过程中A装置中玻璃管内的固体质量随温度的变化曲线(右图).
(1)写出BC段发生反应的化学方程式:
Fe3O4+CO
3FeO+CO2
| ||
Fe3O4+CO
3FeO+CO2
.
| ||
(2)通过计算确定:该Fe3O4样品中含有的杂质是
Fe2O3
Fe2O3
,其中含Fe3O4的质量是20.88
20.88
g.(不需要写过程)某化学兴趣小组的同学对实验室制取氧气的实验展开了如下探究:

(1)小明同学选用如图1所示的装置制取氧气.制取过程中所发生反应的化学反应方程式为:
(2)小雨阅读课外资料得知:双氧水分解除了用二氧化锰还可用氧化铜等物质作催化剂,于是他对氧化铜产生了探究兴趣.
【提出问题】
氧化铜是否也能作氯酸钾分解的催化剂?它是否比二氧化锰催化效果更好?
【设计实验】
小雨以生成等体积的氧气为标准,设计了下列三组实验(其它可能影响实验的因素均忽略).
①上述实验应测量的“待测数据”是
②若实验②比实验①的“待测数据”更
③将实验②反应后的固体经提纯分离仍得到0.5克黑色粉末,再将黑色粉末放入试管中,
【评价设计】你认为小雨设计实验③和实验②对比的目的是
(3)小林同学对“过氧化氢溶液的浓度对反应速度有何影响”展开如下探究:取不同浓度的过氧化氢溶液,在其他条件相同的情况下进行实验,记录数据如下:
①根据以上数据分析过氧化氢溶液的浓度对反应速度有怎样的影响:
②小芳同学验证实验后二氧化锰的质量是否仍为0.5g,她取反应后的溶液进行如下操作:
查看习题详情和答案>>

(1)小明同学选用如图1所示的装置制取氧气.制取过程中所发生反应的化学反应方程式为:
2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
.实验前小明同学先向仪器A中加入水,然后将导气管放入水槽中,并打开仪器A的活塞,观察导气管口是否有连续的气泡出现.该实验操作的目的是
| ||
检查装置的气密性
检查装置的气密性
.(2)小雨阅读课外资料得知:双氧水分解除了用二氧化锰还可用氧化铜等物质作催化剂,于是他对氧化铜产生了探究兴趣.
【提出问题】
氧化铜是否也能作氯酸钾分解的催化剂?它是否比二氧化锰催化效果更好?
【设计实验】
小雨以生成等体积的氧气为标准,设计了下列三组实验(其它可能影响实验的因素均忽略).
| 实验序号 | KClO3质量 | 其他物质质量 | 待测数据 |
| ① | 1.2g | l | |
| ② | 1.2g | CuO 0.5g | |
| ③ | 1.2g | MnO2 0.5g |
得到相同质量的氧气所需要的时间
得到相同质量的氧气所需要的时间
.②若实验②比实验①的“待测数据”更
小
小
(填“大”或“小”),说明氧化铜能加快氯酸钾的分解速率.③将实验②反应后的固体经提纯分离仍得到0.5克黑色粉末,再将黑色粉末放入试管中,
加入氯酸钾固体加热,一会儿就有气泡冒出
加入氯酸钾固体加热,一会儿就有气泡冒出
(简述操作和现象),说明氧化铜还能作氯酸钾的催化剂.【评价设计】你认为小雨设计实验③和实验②对比的目的是
比较氧化铜和二氧化锰哪个催化效果更好
比较氧化铜和二氧化锰哪个催化效果更好
.(3)小林同学对“过氧化氢溶液的浓度对反应速度有何影响”展开如下探究:取不同浓度的过氧化氢溶液,在其他条件相同的情况下进行实验,记录数据如下:
| 实验 | 1 | 2 | 3 | 4 | 5 |
| 过氧化氢溶液的浓度 | 1% | 3% | 5% | 10% | 15% |
| MnO2粉末用量/g | 0.5 | 0.5 | 0.5 | 0.5 | 0.5 |
| 收集到500mL气体时所用时间/秒 | 560 | 186 | 103 | 35 | 12 |
过氧化氢溶液的浓度越大,反应的速度越快
过氧化氢溶液的浓度越大,反应的速度越快
;②小芳同学验证实验后二氧化锰的质量是否仍为0.5g,她取反应后的溶液进行如下操作:
过滤
过滤
、洗涤、干燥、称量,她用如图2所示的装置进行实验,试指出图中的三处错误用烧杯直接向漏斗内倒液体
用烧杯直接向漏斗内倒液体
;液面高于滤纸边缘
液面高于滤纸边缘
;漏斗的下端在烧杯的中央
漏斗的下端在烧杯的中央
.