网址:http://m.1010jiajiao.com/timu3_id_204486[举报]
(1)SO2是一种________色、有________气味的有毒气体,密度比空气________,容易液化,易溶于水(1∶40).
(2)SO2的化学性质丰富多彩.SO2是一种________氧化物,可以与水、碱、碱性氧化物反应.由于SO2分子中硫元素的化合价为+4,处于S的中间价态,所以SO2既可作还原剂(主要),也可作氧化剂(次要).当SO2遇到强氧化剂时,+4价的S可以被氧化为+6价的S,SO2作为还原剂.例如,SO2能与O2反应生成SO3(写出相应的化学方程式,下同):________;SO2还能使溴水褪色:________.当SO2遇到强还原剂时,+4价的S可以被还原为0价的S,SO2作为氧化剂.例如,SO2可以与H2S反应生成单质硫:________.除此之外,SO2能使________褪色,这是因为SO2具有漂白性,能与有色物质化合生成不稳定的无色化合物.
2CuFeS2+2SiO2+5O2=2Cu+2FeSiO3+4SO2.
请回答下列问题:
(1)若CuFeS2中Cu的化合价为+2,则反应中被还原的元素是
(2)黄铜矿冶炼铜产生的炉渣中主要含Fe2O3、FeSiO3、SiO2、Al2O3等,请完成以下验证炉渣中含有+2价的铁的探究过程中的有关问题:
仅限选择的试剂有:
稀盐酸、稀硫酸、稀硝酸、NaOH溶液、KMnO4溶液、KSCN溶液.
①应选用试剂为
②有关的实验现象为
(3)最近我国发现,以黄铜矿为原料在沸腾炉中和空气反应,生成物冷却后经溶解、除铁、结晶得到CuSO4?5H2O,生产成本降低了许多.实验结果如下表:
| 沸腾炉温度/℃ | 560 | 580 | 600 | 620 | 640 | 660 |
| 生成物中含水溶性铜化合物的百分含量/% | 90.12 | 91.24 | 93.50 | 92.38 | 89.96 | 84.23 |
| 生成物中含酸溶性铜化合物的百分含量/% | 92.00 | 93.60 | 97.08 | 97.82 | 98.16 | 98.19 |
②温度高于600℃生成物中水溶性铜化合物百分含量下降的原因是
(4)另据报道,有一种叫Thibacillus ferroxidans的细菌,在酸性溶液中利用氧气可以将黄铜矿氧化成硫酸盐,试写出该反应的化学方程式:
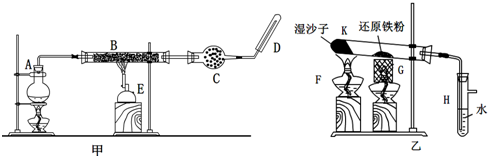
已知:B中放入的是铁与石棉绒的混合物,C中放的是干燥剂,E为酒精喷灯,G为带有铁丝网罩的酒精灯.对比两装置,回答下列问题:
(1)如何检查乙装置的气密性:
(2)乙装置中湿沙子的作用是:
(3)B处发生反应的化学方程式:
(4)对比甲、乙两装置的B和K,B的优点是:
(5)称取mg铁粉与适量石棉绒混合,然后加热至无气体放出.若收集的气体体积换算为标准状况为VL,铁粉的转化率为(列出计算式即可)
(6)为了证明反应后的固体混合物中含有+3价的Fe,该同学取出少量混合物于试管中,加入一定量的盐酸使固体混合物溶解,过滤,立即向滤液中滴加KSCN溶液,结果观察到溶液的颜色没变化.经过思考,该同学认为此现象不能说明反应后的固体混合物中不含有+3价Fe.他的理由是:
查阅资料:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO
提出假设
假设1:红色粉末是Fe2O3 假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验:
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂.
(1)若假设1成立,则实验现象是
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁.你认为这种说法合理吗?
(3)若固体粉末完全溶解,向所得溶液中滴加 KSCN 试剂时溶液不变红色,则证明原固体粉末是
探究延伸:若经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物.
(4)实验小组欲用加热法测定Cu2O的质量分数.取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中Cu2O的质量分数为
| 9(b-a) |
| a |
| 9(b-a) |
| a |
(5)某铝土矿样品经测定是由Al2O3、Fe2O3、FeO、SiO2等氧化物组成,取样品适量放入烧杯中,加入稀硫酸将其溶解,过滤,取滤液少量于试管中,若证明滤液中含有+2价的铁,选用的试剂和现象为
(12分)某同学欲在实验室中完成Fe与水蒸气反应的实验,装置如图甲、乙两种。

已知B中放入的是铁与石棉绒的混合物,C中放的是干燥剂,E为酒精喷灯,G为带有铁丝网罩的酒精灯。
Ⅰ.对比两装置,回答下列问题:
(1)如何检查乙装置的气密性? 。
(2)乙装置中湿沙子的作用是 。
(3)B处发生反应的化学方程式: 。
(4)该同学认为欲在乙装置的尖嘴导管处点燃反应产生的气体,装置H必不可少,H的作用是 。
(5)对比甲、乙两装置的B和K,B的优点是 。
Ⅱ.某同学为了研究一定时间内铁粉的转化率,用上图中的甲装置设计了如下实验:准确称量一定质量的铁粉进行反应,收集并测量反应后生成的气体体积,计算铁粉的转化率。
① 用排水法收集并测量气体体积可选下图中的 装置。

② 称取mg铁粉与适量石棉绒混合,然后加热至无气体放出。若收集的气体体积换算为标准状况为VL,铁粉的转化率为(列出计算式即可) 。
③ 为了证明反应后的固体混合物中含有+3价的Fe,该同学取出少量混合物于试管中,加入足量的盐酸,溶解后过滤,立即向溶液中滴加KSCN溶液,结果观察到溶液的颜色没变化。经过思考,该同学认为此现象不能说明反应后的固体混合物中不含有+3价Fe。他的理由是: 。
查看习题详情和答案>>