摘要:多少molCaCl2溶解在1mol H2O中.才能使与H2O分子的物质的量之比为l:10 A.0.1mol B.10mol C.0.5mol D.0.05mol
网址:http://m.1010jiajiao.com/timu3_id_203671[举报]
氯碱工业中电解饱和食盐水的原理示意图如图所示:
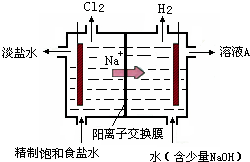
(1)由于生成的氯气可溶于水,并发生下列反应Cl2+H2O?HCl+HClO,电解时用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用
(2)电解所用的盐水需精制.去除食盐水中含有的Ca2+、Mg2+、NH4+、SO42-[c(SO42-)>c(Ca2+)].精致流程如下(淡盐水和溶液A来上述电解池):
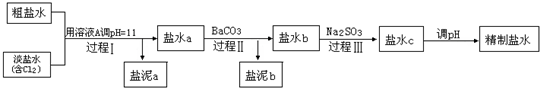
①盐泥a除泥沙外,还含有的物质是
②过程Ⅰ中Cl2将NH4+转化为N2的离子方程式是
③BaSO4的溶解度比BaCO3的小,过程Ⅱ中除去的离子有
④经过程Ⅲ处理,要求盐水c中剩余Na2SO3的含量小于5mg/L,若盐水b中NaClO的含量是7.45mg/L,则处理10m3盐水b,最多添加10%Na2SO3溶液的质量为多少kg?(加入溶液引起的体积变化忽略不计,请写出解题步骤).
查看习题详情和答案>>

(1)由于生成的氯气可溶于水,并发生下列反应Cl2+H2O?HCl+HClO,电解时用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用
氯气在水中存在平衡为Cl2+H2O?HCl+HClO,增大盐酸的浓度可使该平衡向逆反应方向移动,减少氯气在水中的溶解,有利于氯气的逸出
氯气在水中存在平衡为Cl2+H2O?HCl+HClO,增大盐酸的浓度可使该平衡向逆反应方向移动,减少氯气在水中的溶解,有利于氯气的逸出
;(2)电解所用的盐水需精制.去除食盐水中含有的Ca2+、Mg2+、NH4+、SO42-[c(SO42-)>c(Ca2+)].精致流程如下(淡盐水和溶液A来上述电解池):

①盐泥a除泥沙外,还含有的物质是
Mg(OH)2
Mg(OH)2
.②过程Ⅰ中Cl2将NH4+转化为N2的离子方程式是
2NH4++3Cl2+8OH-=N2+6Cl-+8H2O或2NH4++3ClO-+2OH-=N2+3Cl-+5H2O
2NH4++3Cl2+8OH-=N2+6Cl-+8H2O或2NH4++3ClO-+2OH-=N2+3Cl-+5H2O
.③BaSO4的溶解度比BaCO3的小,过程Ⅱ中除去的离子有
Ca2+、SO42-
Ca2+、SO42-
.④经过程Ⅲ处理,要求盐水c中剩余Na2SO3的含量小于5mg/L,若盐水b中NaClO的含量是7.45mg/L,则处理10m3盐水b,最多添加10%Na2SO3溶液的质量为多少kg?(加入溶液引起的体积变化忽略不计,请写出解题步骤).
1.76kg
1.76kg
.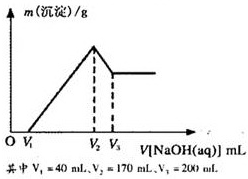 镁铝合金是烟花生产过程中的重要原料,同时也可作为白光剂和照明剂.为了探究镁铝合金中各成分的含量,康康同学将一定质量的镁铝合金投入到850mL、一定物质的量浓度的稀硫酸中,合金全部溶解,然后又滴加5mol/L的NaOH溶液.若在滴加NaOH溶液的过程中,沉淀质量(m)随加入NaOH溶液的体积(V)的变化如图所示.
镁铝合金是烟花生产过程中的重要原料,同时也可作为白光剂和照明剂.为了探究镁铝合金中各成分的含量,康康同学将一定质量的镁铝合金投入到850mL、一定物质的量浓度的稀硫酸中,合金全部溶解,然后又滴加5mol/L的NaOH溶液.若在滴加NaOH溶液的过程中,沉淀质量(m)随加入NaOH溶液的体积(V)的变化如图所示.(1)请写出V2→V3时,发生反应的化学方程式:
Al(OH)3+NaOH=NaAlO2+2H2O
Al(OH)3+NaOH=NaAlO2+2H2O
,由此计算出合金中铝的物质的量为0.15mol
0.15mol
.(2)计算合金中镁的质量.(要有计算过程,下同)
(3)合金在溶于稀硫酸时,释放出的气体体积(标准状况)是多少?
(4)康康同学所用稀硫酸的物质的量浓度是多少?
将32.64g铜与150mL一定浓度的硝酸反应,铜完全溶解后,产生的NO和NO2混合气体在标准状况下的体积为11.2L.(假定反应前后溶液体积不变,也不考虑N2O4的存在.)试计算:
(1)反应后,溶液中硝酸铜物质的量浓度为多少?
(2)混合气体中NO的体积为多少?
(3)若将混合气体经水洗后,体积变为多少?
查看习题详情和答案>>
(1)反应后,溶液中硝酸铜物质的量浓度为多少?
(2)混合气体中NO的体积为多少?
(3)若将混合气体经水洗后,体积变为多少?
某同学在学习过程中了解到蛋壳的主要成分是碳酸钙.于是,该同学设想是不是所有得蛋壳中的含钙量都一样,如果都一样的话,大约是多少?如果不一样的话,蛋壳中的含钙量与什么因素有关呢?于是该同学就以此为课题与其他同学一起开展了一次研究性学习.在研究性学习中,该同学的分工是设计测量蛋壳中含钙量的方案.下面是他设计的一个方案,请你为他补全方案,并回答相关问题.
第一步:收集蛋壳,并洗涤干净备用.
第二步:称量蛋壳质量(m1).
第三步:溶解蛋壳,将蛋壳放入盛有 的烧杯中,搅拌,使其充分反应,过滤除去不溶性杂质,保留滤液备用.蛋壳溶解过程中发生的离子方程式为 .
第四步:沉淀Ca2+.向滤液中加入过量的 溶液.要加入过量的该溶液的原因是 .
第五步:过滤,洗涤沉淀.洗涤沉淀的原因及洗涤的方法是 .
第六步:称量沉淀质量(m2).蛋壳中含钙量(即该元素的质量分数)的表达式为Ca%= .
查看习题详情和答案>>
第一步:收集蛋壳,并洗涤干净备用.
第二步:称量蛋壳质量(m1).
第三步:溶解蛋壳,将蛋壳放入盛有
第四步:沉淀Ca2+.向滤液中加入过量的
第五步:过滤,洗涤沉淀.洗涤沉淀的原因及洗涤的方法是
第六步:称量沉淀质量(m2).蛋壳中含钙量(即该元素的质量分数)的表达式为Ca%=