摘要:15.Cu Fe2+.Cu2+ [说明]因为c<a.所以Cu2+没有全部被还原.可知铁的投入量不足.所以滤渣只有单质铜.又因为2FeCl3+Cu=2FeCl2+CuCl2.可知滤液中不可能存在Fe3.所以滤液中只有Fe2+.Cu2+
网址:http://m.1010jiajiao.com/timu3_id_203287[举报]
向FeCl3溶液中加入ag铜粉,搅拌使之全部溶解,再向其中加入 bg铁粉,充分反应后过滤得滤渣 cg,若已知 a>b>c,则 c克滤渣和溶液中存在的阳离子分别是( )
| A、Fe,Fe2+ | B、Cu,Fe2+、Cu2+ | C、Cu、Fe,Fe2+、Cu2+ | D、Cu,Fe2+ |
CuCl2溶液中含有少量杂质FeCl2,为制备纯净的CuCl2·2H2O晶体,拟定实验步骤如下图所示
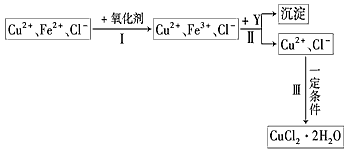
请回答下列问题:
(1)步骤Ⅰ中,将Fe2+转化为Fe3+最好选用下列氧化剂中的________(填字母).
A.K2Cr2O7 B.NaClO C.H2O2
该反应的离子方程式为____________________。
(2)在步骤Ⅱ中,加入Y的目的是为了调节溶液的酸度以促使Fe3+沉淀完全,Y可以是下列物质中的
________(填字母)。
A.NaOH B.Cu C.Cu2(OH)2CO3
(3)步骤Ⅲ应控制的实验条件是________________________。
查看习题详情和答案>>
(1)步骤Ⅰ中,将Fe2+转化为Fe3+最好选用下列氧化剂中的________(填字母).
A.K2Cr2O7 B.NaClO C.H2O2
该反应的离子方程式为____________________。
(2)在步骤Ⅱ中,加入Y的目的是为了调节溶液的酸度以促使Fe3+沉淀完全,Y可以是下列物质中的
________(填字母)。
A.NaOH B.Cu C.Cu2(OH)2CO3
(3)步骤Ⅲ应控制的实验条件是________________________。
|
下列反应的离子方程式书写正确的是 | |
| [ ] | |
A. |
用醋酸除去水垢:CaCO3+2H+=Ca2++H2O+CO2↑ |
B. |
氧化镁与稀硫酸反应:MgO+2H+=Mg2++H2O |
C. |
利用腐蚀法制作印刷线路板:Fe3++Cu=Fe2++Cu2+ |
D. |
稀硫酸与氢氧化钡溶液反应:H++ |
|
下列离子方程式正确的是 | |
| [ ] | |
A. |
铁和盐酸反应:2Fe+6H+=2Fe3++3H2↑ |
B. |
氯化铁和铜反应:Fe3++Cu=Fe2++Cu2+ |
C. |
石灰水与碳酸钠溶液混合:Ca2++ |
D. |
硫酸氢钠溶液中加入氢氧化钡溶液至中性:2H++ |
|
下列离子方程式书写正确的是 | |
| [ ] | |
A. |
在硫酸铜溶液中加入氢氧化钡:Ba2++SO42-=BaSO4↓ |
B. |
CO2通入足量澄清石灰水中:Ca2++2OH-+CO2=CaCO3↓+H2O |
C. |
把金属铁放入稀硫酸中:2Fe+6H+=2Fe3++3H2↑ |
D. |
往FeCl3溶液中加入Cu粉:Fe3++Cu=Fe2++Cu2+ |