网址:http://m.1010jiajiao.com/timu3_id_203204[举报]
pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值。如某溶液溶质的浓度为:1×10-3mol/L,则该溶液中该溶质的pC=-lg1×10-3=3。已知H2CO3溶液中存在的化学平衡为:CO2+H2O![]() H2CO3
H2CO3![]() H+ +HCO3—;HCO3—
H+ +HCO3—;HCO3—![]() H++CO32—。如图为H2CO3溶液的pC-pH图。请回答下列问题:
H++CO32—。如图为H2CO3溶液的pC-pH图。请回答下列问题:

(1)在pH=0~4时,H2CO3溶液中主要存在的离子为: ;在pH=12时,H2CO3溶液中主要存在的含碳阴离子为: ;
(2)pH<5时,溶液中H2CO3的pC值总是约等于3的原因是 ;
(3)一定浓度的NaHCO3和Na2CO3混合溶液是一种“缓冲溶液”,在这种溶液中加入少量的强酸或强碱,溶液的pH变化不大,其原因是
查看习题详情和答案>>pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值.如某溶液溶质的浓度为:1×10-3 mol/L,则该溶液中该溶质的pC=-lg1×10-3=3.已知H2CO3溶液中存在的化学平衡为:CO2+H2O H2CO3
H2CO3 H++HCO3-
H++HCO3- 2H++CO32-.下图为H2CO3溶液的pC-pH图.请回答下列问题:
2H++CO32-.下图为H2CO3溶液的pC-pH图.请回答下列问题:

(1)在pH=0~4时,H2CO3溶液中主要存在的离子为:________;在pH=12时,H2CO3溶液中主要存在的含碳阴离子为:________;
(2)pH<5时,溶液中H2CO3的pC值总是约等于3的原因是________;
(3)一定浓度的NaHCO3和Na2CO3混合溶液是一种“缓冲溶液”,在这种溶液中加入少量的强酸或强碱,溶液的pH变化不大,其原因是________.
方法一:海带、海藻燃烧后所得的灰份中含I-,从中获得I-,由 I- 制备 I2.
某研究性学习小组为了从海带中提取碘,设计并进行了以下实验:
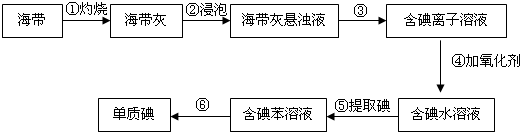
请回答:
(1)步骤①中灼烧海带用到的实验仪器有坩埚钳、铁三脚架、泥三角、酒精灯和
A.试管 B.瓷坩埚 C. 烧杯 D. 量筒
(2)步骤③的实验操作名称是
(3)步骤④中氧化剂最好选用
A.浓硫酸 B.新制氯水
C.酸性KMnO4溶液 D.3%H2O2溶液和稀H2SO4混合液
其反应的离子方程式是
(4)步骤⑤中,学生选择用苯来提取碘,还可以用下列
A.乙酸 B.四氯化碳 C.酒精 D.己烷
(5)步骤⑤中,为了检验提取碘后的水溶液中是否还含有单质碘,取少量上述溶液于试管中,滴加
(6)步骤⑤中为了得到含碘苯溶液,某学生设计了以下操作步骤:
a.将含碘的水溶液置于分液漏斗中
b.加入适量的苯
c.分离出下层液体
d.分离出上层液体,即得到含碘苯溶液
以上设计中有遗漏的操作.应该在步骤
方法二:从智利硝石中获得碘酸钠(NaIO3),再用NaHSO3把碘酸钠还原为I2.实际生产中分两步进行:
第一步:先用适量的 NaHSO3将碘酸钠还原成I-,反应的离子方程式为:
IO3-+3HSO3-=I-+3SO42-+3H+;
第二步:向所得的酸性I-溶液中加入适量的碘酸钠(NaIO3)溶液便有碘析出,反应的离子方程式为
(1)A、B、D的化学式分别是A
(2)已知8gD与O2完全反应,生成稳定化合物时放出445kJ的热量,写出反应的热化学方程式
(3)若C为第一和第二周期元素组成的化合物.
①C的溶液中加入少量的二氧化锰,有无色气体生成,写出化学方程式
| ||
| ||
②C的溶液中加入足量二氧化锰和稀硫酸,二氧化锰逐渐溶解生成Mn2+,反应中二氧化锰做
③当C分别发生①和②两个反应时,若都有1molC完全反应,①和②两个反应中转移电子数之比是:
(1)保存碘单质时应注意的问题是
(2)碘不易溶于水,但易溶于碘化钾溶液并生成多碘离子:
I2(aq)+I-(aq)?I3-(aq)△H<0…①
I2(aq)+2I-(aq)?I42-(aq)…②
反应②的平衡常数K=
温度升高时,反应①的平衡常数将
(3)某化学课外小组用海带为原料制得少量含碘离子的溶液.现用该溶液进行下列实验:
①用高锰酸钾滴定法测碘离子浓度.反应为:
2MnO4-+10I-+16H+=2Mn2++5I2+8H2O
滴定20.00mL该溶液需0.10mol?L-1的酸性高锰酸钾溶液10.25mL,则该溶液中碘离子的浓度为
②用下列流程制取少量碘单质:

步骤①的离子方程式为
(4)I2O5是白色粉末状固体,可用作氧化剂使H2S、CO、HCl等氧化,在合成氨工业中常用I2O5来定量测量CO的含量.
已知:2I2(s)+5O2(g)=2I2O5(s)△H=-75.56kJ?mol-1
2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ?mol-1
写出CO(g)与I2O5(s)反应析出固态I2的热化学方程式: