网址:http://m.1010jiajiao.com/timu3_id_203127[举报]
过氧化氢水溶液俗称双氧水,沸点比水高,遇光、热及重金属化合物等均能引起分解。
(1)某试剂厂先制得7%~8%的双氧水,欲将其浓缩成30%的溶液,适宜方法是
(填写编号)。
a.常压蒸馏 b.减压蒸馏 c.加入生石灰常压蒸馏 d.加压蒸馏
(2)如果得到的双氧水中氧元素的含量为90%,则过氧化氢的纯度为 。众所周知,氢气在空气中燃烧生成水。有人提出,氢气在空气中燃烧也可能生成H2O2,但它因高温而分解了。为了验证氢气在空气中燃烧的产物中是否含有H2O2,某课外小组同学设计的实验装置见图-1。

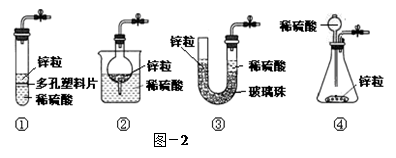
(3)甲同学想从下图-2的①-④中选取替代图-1方框中的装置,可行的是 (填写编号)。

(4)若乙同学用酸性高锰酸钾溶液检测到了H2O2的存在,完成该反应的离子方程式:
→ + Mn2+ + H2O
丙同学对乙的检验方案提出了质疑:若锌粒与稀硫酸的反应中产生了少量H2S等还原性气体,也会使酸性高锰酸钾溶液褪色。请对乙同学的实验方案提出改进建议: 。
(5)过碳酸钠(2Na2CO3•3H2O2)俗称固体双氧水,极易分解,其分解反应的化学方程式可表示为:2 (2Na2CO3•3H2O2) → 4Na2CO3 + 6H2O + 3O2↑
取一定量的过碳酸钠在密闭容器中使它完全分解,测得生成氧气12.0g。冷却到室温后,向所得产物中加水配制成10.6% 的Na2CO3溶液,需加水 g。
查看习题详情和答案>>
过氧化氢水溶液俗称双氧水,沸点比水高,遇光、热及重金属化合物等均能引起分解。
(1)某试剂厂先制得7%~8%的双氧水,欲将其浓缩成30%的溶液,适宜方法是
(填写编号)。
a.常压蒸馏 b.减压蒸馏 c.加入生石灰常压蒸馏 d.加压蒸馏
(2)如果得到的双氧水中氧元素的含量为90%,则过氧化氢的纯度为 。众所周知,氢气在空气中燃烧生成水。有人提出,氢气在空气中燃烧也可能生成H2O2,但它因高温而分解了。为了验证氢气在空气中燃烧的产物中是否含有H2O2,某课外小组同学设计的实验装置见图-1。
(3)甲同学想从下图-2的①-④中选取替代图-1方框中的装置,可行的是 (填写编号)。
(4)若乙同学用酸性高锰酸钾溶液检测到了H2O2的存在,完成该反应的离子方程式:
→ + Mn2+ + H2O
丙同学对乙的检验方案提出了质疑:若锌粒与稀硫酸的反应中产生了少量H2S等还原性气体,也会使酸性高锰酸钾溶液褪色。请对乙同学的实验方案提出改进建议: 。
(5)过碳酸钠(2Na2CO3?3H2O2)俗称固体双氧水,极易分解,其分解反应的化学方程式可表示为:2 (2Na2CO3?3H2O2) → 4Na2CO3 + 6H2O + 3O2↑
取一定量的过碳酸钠在密闭容器中使它完全分解,测得生成氧气12.0g。冷却到室温后,向所得产物中加水配制成10.6% 的Na2CO3溶液,需加水 g。
(1)某试剂厂先制得7%~8%的双氧水,欲将其浓缩成30%的溶液,适宜方法是
(填写编号)。
a.常压蒸馏 b.减压蒸馏 c.加入生石灰常压蒸馏 d.加压蒸馏
(2)如果得到的双氧水中氧元素的含量为90%,则过氧化氢的纯度为 。众所周知,氢气在空气中燃烧生成水。有人提出,氢气在空气中燃烧也可能生成H2O2,但它因高温而分解了。为了验证氢气在空气中燃烧的产物中是否含有H2O2,某课外小组同学设计的实验装置见图-1。

(3)甲同学想从下图-2的①-④中选取替代图-1方框中的装置,可行的是 (填写编号)。
(4)若乙同学用酸性高锰酸钾溶液检测到了H2O2的存在,完成该反应的离子方程式:
→ + Mn2+ + H2O
丙同学对乙的检验方案提出了质疑:若锌粒与稀硫酸的反应中产生了少量H2S等还原性气体,也会使酸性高锰酸钾溶液褪色。请对乙同学的实验方案提出改进建议: 。
(5)过碳酸钠(2Na2CO3?3H2O2)俗称固体双氧水,极易分解,其分解反应的化学方程式可表示为:2 (2Na2CO3?3H2O2) → 4Na2CO3 + 6H2O + 3O2↑
取一定量的过碳酸钠在密闭容器中使它完全分解,测得生成氧气12.0g。冷却到室温后,向所得产物中加水配制成10.6% 的Na2CO3溶液,需加水 g。
(14分)1-乙氧基萘是一种无色液体,密度比水大,不溶于水,易溶于醇、醚,熔点5.5 ℃,沸点267.4 ℃。1-乙氧基萘常用作香料,也可作为合成其他香料的原料。实验室制备1-乙氧基萘的过程如下:
(1)将混合液置于如图所示的容器中加热充分反应。实验中使用过
量乙醇的原因是 。烧瓶上连接长直玻璃管的主要
作用是 。
(2)反应结束,将烧瓶中的液体倒入冷水中,经处理得到有机层。为提纯产物有以下四步操作:①蒸馏②水洗并分液③用10%的NaOH溶液碱洗并分液 ④用无水氯化钙干燥并过滤。正确的顺序是 。
A.③②④① B.①②③④ C.②①③④
(3)蒸馏时所用的玻璃仪器除了酒精灯、冷凝管、接收器、
锥形瓶外还有 , 。
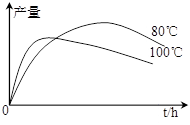
(4)实验测得1-乙氧基萘的产量与反应时间、温度的变化
如图所示,时间延长、温度升高1-乙氧基萘的产量下
降的原因可能是 、 。
(5)用金属钠可检验1-乙氧基萘是否纯净,简述实验现象与结论: 。
查看习题详情和答案>>
(14分)1-乙氧基萘是一种无色液体,密度比水大,不溶于水,易溶于醇、醚,熔点5.5 ℃,沸点267.4 ℃。1-乙氧基萘常用作香料,也可作为合成其他香料的原料。实验室制备1-乙氧基萘的过程如下: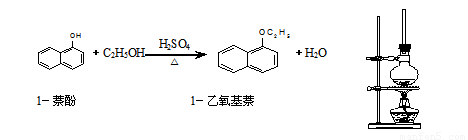
(1)将混合液置于如图所示的容器中加热充分反应。实验中使用过
量乙醇的原因是 。烧瓶上连接长直玻璃管的主要
作用是 。
(2)反应结束,将烧瓶中的液体倒入冷水中,经处理得到有机层。为提纯产物有以下四步操作: ①蒸馏 ②水洗并分液 ③用10%的NaOH溶液碱洗并分液 ④用无水氯化钙干燥并过滤。正确的顺序是 。
A.③②④① B.①②③④ C.②①③④
(3)蒸馏时所用的玻璃仪器除了酒精灯、冷凝管、接收器、
锥形瓶外还有 , 。
(4)实验测得1-乙氧基萘的产量与反应时间、温度的变化
如图所示,时间延长、温度升高1-乙氧基萘的产量下
降的原因可能是 、 。

(5)用金属钠可检验1-乙氧基萘是否纯净,简述实验现象与结论: 。
查看习题详情和答案>>