网址:http://m.1010jiajiao.com/timu3_id_203065[举报]
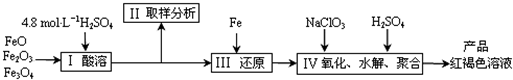
(1)实验室用18.4mol?L-1的浓硫酸配制250mL4.8mol?L-1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和吸量管(一种带有刻度的移液管)外,还需
(2)步骤Ⅱ取样分析溶液中的Fe2+、Fe3+的含量,目的是
A.控制溶液中Fe2+与Fe3+含量比 B.确定下一步还原所需铁的量
C.确定氧化Fe2+所需NaClO3的量 D.确保铁的氧化物酸溶完全
(3)写出步骤Ⅳ中用NaClO3氧化时的离子方程式
已知1mol HNO3的价格为0.16元,1mol NaClO3的价格为0.45元,评价用HNO3代替NaClO3作为氧化剂的利弊,利是
(4)为了分析产品聚合硫酸铁溶液中SO42-与Fe3+物质的量之比,有人设计了以下操作:
(a)取25mL聚合硫酸铁溶液,加入足量的BaCl2溶液,产生白色沉淀,白色沉淀经过过滤、洗涤、干燥后,称重,其质量为m g.
(b)另取25mL聚合硫酸铁溶液,加足量铜粉,充分反应后过滤、洗涤,将滤液和洗液合并配成250mL溶液,取该溶液25.00mL,用KMnO4酸性溶液滴定,到达终点时用去0.1000mol/L KMnO4标准溶液VmL.反应的离子方程式为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
回答下列问题:
①判断(a)步骤溶液中SO42-离子已沉淀完全的方法是
②在(b)步骤中判断达到终点的现象是
③聚合硫酸铁中SO42-与Fe3+的物质的量之比为
| m |
| 233 |
| V |
| 200 |
| m |
| 233 |
| V |
| 200 |
(1)写出反应的离子方程式
(2)使用过的腐蚀液会失效,但还可以回收利用,其中有一步需要将Fe2+转化为Fe3+,下列试剂能实现上述变化的是
A.氯气 B.稀硫酸 C.铁 D.双氧水
(3)某课外活动小组为确认生产后的废液的组成,进行如下实验:
Ⅰ.取50mL废液稀释配成250mL溶液.
Ⅱ.从250mL稀释溶液取25mL加入足量的AgNO3溶液,生成不溶于硝酸的沉淀8.61g.
Ⅲ.另从250mL稀释溶液取25mL放入铜片充分反应,铜片质量减少了0.256g.
①操作I是配制物质的量浓度溶液,所用到的玻璃仪器除量筒、烧杯、玻璃棒外,还必须有
②下列操作可能使所配溶液浓度偏小的是
A 配溶液前容量瓶中有少量蒸馏水
B 定容时俯视容量瓶的刻度线
C 未洗涤烧杯和玻璃棒
D 摇匀后,发现液面低于刻度线后继续加水至凹液面与刻度线相切
③原废液中氯离子的物质的量浓度是
为探究某铁碳合金与浓硫酸在加热条件下的反应的部分产物并测定铁碳合金中铁元素的质量分数,某化学活动小组设计了下图所示的实验装置,并完成以下实验探究。




(1)往圆底烧瓶中加入m g铁碳合金,并滴入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是:①常温下,Fe在浓硫酸中钝化;② 。
(2)反应一段时间后,从A中逸出气体的速率仍然较快,除因反应温度较高外,还可能的原因是 。
(3)装置B的作用是 。
(4)甲同学观察到装置C中有白色沉淀生成,他得出了使澄清石灰水变浑浊的气体是二氧化碳。
装置A中能产生二氧化碳的化学方程式为 。
(5)乙同学认为甲同学的结论是错误的,他认为为了确认二氧化碳的存在,需在装置B-C之间添加装置M。装置E、F中盛放的试剂分别是 、 。
重新实验后观察到装置F中的现象是 。
(6)有些同学认为合金中铁元素的质量分数可用KMnO4溶液来测定。
(5Fe2+ + MnO4—+ 8H+ ==5Fe3+ + Mn2+ + 4H2O)。
测定铁元素质量分数的实验步骤如下:
I.往烧瓶A中加入过量的还原剂使溶液中的Fe3+完全转化为Fe2+,过滤,得到滤液B;
II.将滤液B稀释为250 mL;
III.取稀释液25.00 mL,用浓度为c mol·L—1的酸性KMnO4溶液滴定,三次滴定实验所需KMnO4溶液体积的平均值为V mL。
①步骤Ⅱ中,将滤液B稀释为250 mL需要用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,还必须要用到的是 ;
②丙同学设计了下列滴定方式(夹持仪器省略),最合理的是 。(填字母序号)

③滴定过程中 (填“需要”或“不需要”)加入指示剂,如需要,应加入的指示剂是 。
④铁碳合金中铁元素的质量分数为 。
查看习题详情和答案>>
为探究某铁碳合金与浓硫酸在加热条件下的反应的部分产物并测定铁碳合金中铁元素的质量分数,某化学活动小组设计了下图所示的实验装置,并完成以下实验探究。
|
|

 (1)往圆底烧瓶中加入m g铁碳合金,并滴入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是:①常温下,Fe在浓硫酸中钝化;② 。
(1)往圆底烧瓶中加入m g铁碳合金,并滴入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是:①常温下,Fe在浓硫酸中钝化;② 。(2)反应一段时间后,从A中逸出气体的速率仍然较快,除因反应温度较高外,还可能的原因是 。
(3)装置B的作用是 。
(4)甲同学观察到装置C中有白色沉淀生成,他得出了使澄清石灰水变浑浊的气体是二氧化碳。
装置A中能产生二氧化碳的化学方程式为 。
(5)乙同学认为甲同学的结论是错误的,他认为为了确认二氧化碳的存在,需在装置B-C之间添加装置M。装置E、F中盛放的试剂分别是 、 。
重新实验后观察到装置F中的现象是 。
(6)有些同学认为合金中铁元素的质量分数可用KMnO4溶液来测定。
(5Fe2+ + MnO4—+ 8H+ ==5Fe3+ + Mn2+ + 4H2O)。
测定铁元素质量分数的实验步骤如下:
I.往烧瓶A中加入过量的还原剂使溶液中的Fe3+完全转化为Fe2+,过滤,得到滤液B;
II.将滤液B稀释为250 mL;
III.取稀释液25.00 mL,用浓度为c mol·L—1的酸性KMnO4溶液滴定,三次滴定实验所需KMnO4溶液体积的平均值为V mL。
①步骤Ⅱ中,将滤液B稀释为250 mL需要用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,还必须要用到的是 ;
②丙同学设计了下列滴定方式(夹持仪器省略),最合理的是 。(填字母序号)

③滴定过程中 (填“需要”或“不需要”)加入指示剂,如需要,应加入的指示剂是 。
④铁碳合金中铁元素的质量分数为 。 查看习题详情和答案>>