摘要:右图是用一定量的NaHSO4溶液进行导电性实验.发现灯泡较亮.向其中逐滴滴入Ba(OH)2溶液直至过量.观察的现象是: (2)向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至中性,请写出发生反应的离子方程式:
网址:http://m.1010jiajiao.com/timu3_id_202536[举报]
右图是元素周期表的一部分,各元素在周期表中的位置如下,据此回答下列问题:
(1)下列各组元素中最容易形成离子键的是
A、c和h B、b和k C、e和j D、e和i
(2)下列由a~k形成的各分子中,所有原子都满足最外层电子数8电子结构的是
A、ga3 B、ak C、hk3 D、ek4
(3)请用化学方程式解释下列现象
①玻璃容器不能盛放j的氢化物的水溶液:
②b的氧化物对应的水化物溶液不能贮存在d制品中:
查看习题详情和答案>>
| a | |||||||
| e | g | i | j | ||||
| b | c | d | f | h | k | l | |
B
B
,最容易形成共价键的是D
D
A、c和h B、b和k C、e和j D、e和i
(2)下列由a~k形成的各分子中,所有原子都满足最外层电子数8电子结构的是
CD
CD
A、ga3 B、ak C、hk3 D、ek4
(3)请用化学方程式解释下列现象
①玻璃容器不能盛放j的氢化物的水溶液:
4HF+SiO2=SiF4↑+2H2O
4HF+SiO2=SiF4↑+2H2O
②b的氧化物对应的水化物溶液不能贮存在d制品中:
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
. SnCl4的制备需分两步进行,第一步是金属Sn的制备,第二步由Sn和Cl2反应生成SnCl4.
SnCl4的制备需分两步进行,第一步是金属Sn的制备,第二步由Sn和Cl2反应生成SnCl4.第一步:金属Sn的制备--以锡石SnO2为原料,用足量的焦炭作还原剂,在高温下可制得粗锡,该反应的化学方程式为:
SnO2+2C
Sn+2CO
| ||
SnO2+2C
Sn+2CO
,粗锡经电解精炼可得纯锡,精炼时的阴极反应式为
| ||
Sn2++2e-=Sn
Sn2++2e-=Sn
.第二步:SnCl4的制备--用干燥、纯净的Cl2与熔融的Sn反应制SnCl4,同时放出大量的热.已知SnCl4常温下是无色液体,沸点114℃,遇潮湿空气便发生水解反应,Sn的熔点:231℃,右图是制取SnCl4的实验装置.
试回答以下问题:
(1)装置A中反应的化学方程式为
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
| ||
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
;
| ||
(2)当反应生成SnCl4时,应熄灭
B
B
处的酒精灯,理由是依靠反应放出的热量维持Sn的熔化
依靠反应放出的热量维持Sn的熔化
;(3)装置B的主要缺点是
缺少温度计
缺少温度计
,装置D的主要缺点是装置D后应连接一个装有碱石灰的干燥管
装置D后应连接一个装有碱石灰的干燥管
;(4)即使装置B和装置D进行改进后,老师说该实验装置设计仍不完整,请你协助该研究小组设计出所缺装置(须标出试剂的名称)并在下边方框中画出.

 元素在周期表中的位置,反映了元素的原子结构和元素的性质.右图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素的性质.右图是元素周期表的一部分.(1)阴影部分元素N的最高价氧化物为
N2O5
N2O5
.根据元素周期律,请你预测:H3AsO4、H3PO4的酸性强弱:H3AsO4<
<
H3PO4.(用“>”、“<”或“=”表示)(2)元素S的最高正价和最低负价分别为
+6
+6
、-2
-2
,(3)在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),请判断在相同条件下Se与H2反应的限度
更小
更小
(选填“更大”、“更小”或“相同”).(4)羰基硫(COS)分子结构与二氧化碳分子结构相似,所有原子的最外层都满足8电子结构.请写出羰基硫分子的电子式


(5)单质砷和热的浓H2SO4反应,生成As2O3,反应的化学方程式为
2As+3H2SO4(浓)
As2O3+3SO2↑+3H2O
| ||
2As+3H2SO4(浓)
As2O3+3SO2↑+3H2O
.
| ||
我国目前制备多晶硅主要采用三氯氢硅氢还原法、硅烷热解法和四氯化硅氢还原法.由于三氯氢硅还原法具有一定优点,被广泛应用.其简化的工艺流程如图所示:
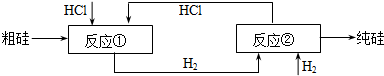
反应①:Si(粗)+3HCl(g)
SiHCl3(l)+H2(g)
反应②:SiHCl3+H2
Si(纯)+3HCl
(1)制备三氯氢硅的反应为:Si(s)+3HCl(g)═SiHCl3(g)+H2(g);△H=-210kJ?mol-1.伴随的副反应有:Si(s)+4HCl(g)═SiCl4(g)+2H2(g);△H=-241kJ?mol-1.SiCl4在一定条件下与H2反应可转化为SiHCl3,反应的热化学方程式为:SiCl4(g)+H2(g)═SiHCl3(g)+HCl(g);△H=
(2)假设在每一轮次的投料生产中,硅元素没有损失,反应①HCl中的利用率为75%,反应②中和H2的利用率为80%.则在下一轮次的生产中,需补充投入HCl和H2的体积比是
(3)由于SiH4具有易提纯的特点,因此硅烷热分解法是制备高纯硅很有发展潜力的方法.工业上广泛采用的合成硅烷方法是让硅化镁和固体氯化铵在液氨介质中反应得到硅烷,化学方程式是
整个制备过程必须严格控制无水,否则反应将不能生成硅烷,而是生成硅酸和氢气等,其化学方程式为
整个系统还必须与氧隔绝,其原因是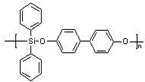
(4)若将硅棒与铁棒用导线相连浸在氢氧化钠溶液中构成原电池,则负极的电极反应式为:
(5)硅能用于合成硅橡胶,右图是硅橡胶中的一种,其主要优点是玻璃化温度低,耐辐射性能好,则该硅橡胶的化学式为
查看习题详情和答案>>

反应①:Si(粗)+3HCl(g)
| ||
反应②:SiHCl3+H2
| ||
(1)制备三氯氢硅的反应为:Si(s)+3HCl(g)═SiHCl3(g)+H2(g);△H=-210kJ?mol-1.伴随的副反应有:Si(s)+4HCl(g)═SiCl4(g)+2H2(g);△H=-241kJ?mol-1.SiCl4在一定条件下与H2反应可转化为SiHCl3,反应的热化学方程式为:SiCl4(g)+H2(g)═SiHCl3(g)+HCl(g);△H=
+31kJ?mol-1
+31kJ?mol-1
.(2)假设在每一轮次的投料生产中,硅元素没有损失,反应①HCl中的利用率为75%,反应②中和H2的利用率为80%.则在下一轮次的生产中,需补充投入HCl和H2的体积比是
4:1
4:1
.(3)由于SiH4具有易提纯的特点,因此硅烷热分解法是制备高纯硅很有发展潜力的方法.工业上广泛采用的合成硅烷方法是让硅化镁和固体氯化铵在液氨介质中反应得到硅烷,化学方程式是
Mg2Si+4NH4Cl═SiH4↑+2MgCl2+4NH3↑
Mg2Si+4NH4Cl═SiH4↑+2MgCl2+4NH3↑
;整个制备过程必须严格控制无水,否则反应将不能生成硅烷,而是生成硅酸和氢气等,其化学方程式为
Mg2Si+4NH4Cl+3H2O═2MgCl2+H2SiO3+4NH3↑+4H2↑
Mg2Si+4NH4Cl+3H2O═2MgCl2+H2SiO3+4NH3↑+4H2↑
;整个系统还必须与氧隔绝,其原因是
由于硅烷在空气中易燃,浓度高时容易发生爆炸
由于硅烷在空气中易燃,浓度高时容易发生爆炸
.
(4)若将硅棒与铁棒用导线相连浸在氢氧化钠溶液中构成原电池,则负极的电极反应式为:
Si+6OH--4e-=SiO32-+3H2O
Si+6OH--4e-=SiO32-+3H2O
(5)硅能用于合成硅橡胶,右图是硅橡胶中的一种,其主要优点是玻璃化温度低,耐辐射性能好,则该硅橡胶的化学式为
(C24H18SiO2)n
(C24H18SiO2)n
. 右图是用0.1mol?L-1 CH3COOH溶液滴定20mL 0.1mol?L-1NaOH溶液的滴定曲线.该溶液中有关粒子浓度的关系式不正确的是( )
右图是用0.1mol?L-1 CH3COOH溶液滴定20mL 0.1mol?L-1NaOH溶液的滴定曲线.该溶液中有关粒子浓度的关系式不正确的是( )